题目内容
【题目】I.以下是元素周期表的一部分,根据图示回答下列问题:
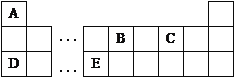
(1)将16.25gFeCl3投入足量A2C2溶液中,产生大量气泡,反应完全后,FeCl3的质量为__________g。
(2)1.3gB2A2气体完全燃烧,恢复至室温,放出65kJ热量,写出代表B2A2燃烧热的热化学反应方程式_____________________________________________________________。
(3)D的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为:
_____________________________________________________________。
II.X、Y、Z、W四种元素是周期表前四周期元素,X原子的核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的外围电子排布式为3d64s2,W的价层电子排布式为ndn+5(n+1)sn-1。
(4)X在元素周期表中的位置___________________________;W元素的名称为_________。
(5)XY2分子中各原子均满足8电子稳定结构,画出XY2的电子式____________。
(6)电负性X_______Y;Z的原子结构示意图为____________________。
【答案】(1)16.25
(2)C2H2(g)+5/2O2(g) = 2CO2(g)+H2O(l) ΔH=-1300kJ/mol
(3) Al(OH)3+OH- = AlO2-+2H2O[或Al(OH)3+OH- = Al(OH)4-]
(4)第三周期ⅥA族; 镍
(5)![]()
(6)<;![]()
【解析】试题分析:根据元素周期表A、B、C、D、E分别是H、C、O、Na、Al。
(1)将16.25gFeCl3投入足量H2O2溶液中,产生大量气泡,FeCl3只起催化作用,反应完全后,FeCl3的质量为16.25g。
(2)1.3gC2H2气体完全燃烧,恢复至室温,放出65kJ热量,1molC2H2气体完全燃烧放热1300kJ,代表 C2H2燃烧热的热化学反应方程式C2H2(g)+5/2O2(g) = 2CO2(g)+H2O(l) ΔH=-1300kJ/mol。
(3)氢氧化钠与氢氧化铝反应的离子方程式为:Al(OH)3+OH-= AlO2-+2H2O[或Al(OH)3+OH-= Al(OH)4-]。
II.X、Y、Z、W四种元素是周期表前四周期元素,X原子的核外有16种不同运动状态的电子,X是S元素;Y的原子序数比X大1,Y是Cl元素;Z原子的外围电子排布式为3d64s2,Z是Fe元素;W的价层电子排布式为ndn+5(n+1)sn-1,n=3,则W的价层电子排布式为3d84s2,W是Ni元素。
(4) S在元素周期表中的位置第三周期ⅥA族;Ni元素的名称为镍。
(5)SCl2XY2的电子式![]() 。
。
(6)电负性S<Cl;Fe的原子结构示意图为![]()

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案