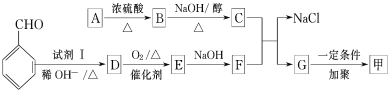
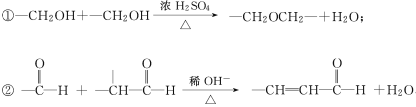
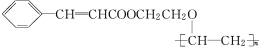题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为___ ___。利用反应6NO2+8NH3=7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) △H= -196.6kJ/mol
2SO3(g) △H= -196.6kJ/mol
2NO(g)+O2(g) ![]() 2NO2(g) △H= -113.0kJ/mol
2NO2(g) △H= -113.0kJ/mol
则反应NO2(g)+SO2(g) =SO3(g)+NO(g)的△H=______kJ/mol。
(3)如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2(g)+O2(g) ![]() 2SO3(g)的反应。问:
2SO3(g)的反应。问:
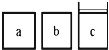
①起始a、c两容器的反应速率大小关系为Va_____Vc;(填“>”“<”或“=”下同)
②反应一段时间后a、c中速率大小关系为Va_____Vc;
③如起始在a、c两容器中通入等量的He,则此时三容器起始压强为Pa_____Pb_____Pc;起始反应速率关系为Va_____Vb_____Vc。
【答案】(12分)
(1)3NO2+H2O═2HNO3+NO;6.72;
(2)-41.8kJ/mol;
(3)①= ;②< ; ③> ;= ;= ;>。
【解析】
试题分析:(1)二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO,反应6NO2+8NH3![]() 7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6mol NO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO2 0.3mol,体积为V(NO2)= 0.3mol×22.4L/mol=6.72L;(2)已知:①2SO2(g)+O2(g)
7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6mol NO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO2 0.3mol,体积为V(NO2)= 0.3mol×22.4L/mol=6.72L;(2)已知:①2SO2(g)+O2(g) ![]() 2SO3(g) △H= -196.6kJ/mol,②2NO(g)+O2(g)
2SO3(g) △H= -196.6kJ/mol,②2NO(g)+O2(g) ![]() 2NO2(g) △H= -113.0kJ/mol,利用盖斯定律将(①-②)÷2,整理可得得NO2(g)+SO2(g) =SO3(g)+NO(g)=-41.8kJmol-1;(3)①起始时压强相等,则反应物的浓度相等,反应速率相等,故答案为Va=Vc:;②c为恒压,由于该反应的正反应是气体物质的量减小的反应,所以反应一段时间后,c中压强大于a,压强越大,物质的浓度就越大,反应速率就越快,因此反应一段时间后a、c中速率大小关系为Va<Vc;③如起始在a、c两容器中通入同量的He ,He不参加反应,c保持恒压,则体积应增大,则此时三容器起始压强为Pa =Pb>Pc ,反应速率Va =Vb ,由于c体积最大,浓度最小,则反应速率最小,三个容器中的气体反应速率关系是Va=Vb>Vc。
2NO2(g) △H= -113.0kJ/mol,利用盖斯定律将(①-②)÷2,整理可得得NO2(g)+SO2(g) =SO3(g)+NO(g)=-41.8kJmol-1;(3)①起始时压强相等,则反应物的浓度相等,反应速率相等,故答案为Va=Vc:;②c为恒压,由于该反应的正反应是气体物质的量减小的反应,所以反应一段时间后,c中压强大于a,压强越大,物质的浓度就越大,反应速率就越快,因此反应一段时间后a、c中速率大小关系为Va<Vc;③如起始在a、c两容器中通入同量的He ,He不参加反应,c保持恒压,则体积应增大,则此时三容器起始压强为Pa =Pb>Pc ,反应速率Va =Vb ,由于c体积最大,浓度最小,则反应速率最小,三个容器中的气体反应速率关系是Va=Vb>Vc。