题目内容
Ⅰ.填写下列空白
(1)NaHSO4在溶液中的电离方程式为:
(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,其离子方程式为
(3)向NaHCO3溶液中滴加过量的Ba(OH)2溶液,其离子方程式为
(4)向20mL 0.1mol/L的Ba(OH)2溶液中通入CO2,当得到0.001molBaCO3沉淀时,通入CO2的物质的量可以是
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是
(3)写出该反应的化学方程式,并标出电子转移的方向和数目

(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
(1)NaHSO4在溶液中的电离方程式为:
NaHSO4=Na++H++SO42-
NaHSO4=Na++H++SO42-
(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,其离子方程式为
Ba2++SO42-+2OH--+2H+=BaSO4↓+2H2O
Ba2++SO42-+2OH--+2H+=BaSO4↓+2H2O
(3)向NaHCO3溶液中滴加过量的Ba(OH)2溶液,其离子方程式为
HCO3-+Ba2++OH-=H2O+BaCO3↓
HCO3-+Ba2++OH-=H2O+BaCO3↓
(4)向20mL 0.1mol/L的Ba(OH)2溶液中通入CO2,当得到0.001molBaCO3沉淀时,通入CO2的物质的量可以是
0.001或0.003
0.001或0.003
molⅡ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是
H2O2
H2O2
.(2)该反应中,发生还原反应的过程是
H2CrO4
H2CrO4
→Cr(OH)3
Cr(OH)3
.(3)写出该反应的化学方程式,并标出电子转移的方向和数目


(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
3.36L
3.36L
.分析:Ⅰ.(1)为强电解质,完全电离;
(2)至中性,以2:1反应,生成硫酸钡、硫酸钠、水;
(3)NaHCO3完全反应,反应生成碳酸钡、水、NaOH;
(4)n[Ba(OH)2]=0.002mol,得到0.001molBaCO3沉淀时,有二氧化碳不足与过量两种情况;
Ⅱ.该反应中H2O2只发生如下过程:H2O2→O2,O元素化合价升高,H2O2被氧化,根据化合价的变化可知,反应中H2CrO4为氧化剂,被还原为Cr(OH)3,反应的方程式为2+3H2O2=2Cr(OH)3+3O2↑+2H2O,根据化合价的变化判断电子转移的数目,以此解答该题.
(2)至中性,以2:1反应,生成硫酸钡、硫酸钠、水;
(3)NaHCO3完全反应,反应生成碳酸钡、水、NaOH;
(4)n[Ba(OH)2]=0.002mol,得到0.001molBaCO3沉淀时,有二氧化碳不足与过量两种情况;
Ⅱ.该反应中H2O2只发生如下过程:H2O2→O2,O元素化合价升高,H2O2被氧化,根据化合价的变化可知,反应中H2CrO4为氧化剂,被还原为Cr(OH)3,反应的方程式为2+3H2O2=2Cr(OH)3+3O2↑+2H2O,根据化合价的变化判断电子转移的数目,以此解答该题.
解答:解:Ⅰ.(1)为强电解质,完全电离,电离方程式为NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2)至中性,以2:1反应,生成硫酸钡、硫酸钠、水,离子反应为Ba2++SO42-+2OH--+2H+=BaSO4↓+2H2O,故答案为:Ba2++SO42-+2OH--+2H+=BaSO4↓+2H2O;
(3)NaHCO3完全反应,反应生成碳酸钡、水、NaOH,离子反应为HCO3-+Ba2++OH-=H2O+BaCO3↓,故答案为:HCO3-+Ba2++OH-=H2O+BaCO3↓;
(4)n[Ba(OH)2]=0.002mol,得到0.001molBaCO3沉淀时,有二氧化碳不足与过量两种情况,如不足,n(CO2)=n(BaCO3)=0.001mol,若过量,则n(CO2)=0.002mol+0.001mol=0.003mol,故答案为:0.001或0.003;
Ⅱ.(1)H2O2→O2的过程中,氧元素的化合价由-1价升到了0价,所以H2O2是还原剂,故答案为:H2O2;
(2)反应中Cr元素化合价降低,H2CrO4应被还原生成Cr(OH)3,故答案为:H2CrO4;Cr(OH)3;
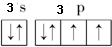
(3)反应的方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,反应中Cr元素化合价由+6价降低为+3价,O元素化合价由-1价升高到0价,则转移电子数目和方向可表示为 ,
,
故答案为: ;
;
(4)由反应可知,生成3molO2转移6mol电子,则转移了0.3mol电子,则产生的气体在标准状况下体积为0.15mol×22.4L/mol=3.36 L,故答案为:3.36 L.
(2)至中性,以2:1反应,生成硫酸钡、硫酸钠、水,离子反应为Ba2++SO42-+2OH--+2H+=BaSO4↓+2H2O,故答案为:Ba2++SO42-+2OH--+2H+=BaSO4↓+2H2O;
(3)NaHCO3完全反应,反应生成碳酸钡、水、NaOH,离子反应为HCO3-+Ba2++OH-=H2O+BaCO3↓,故答案为:HCO3-+Ba2++OH-=H2O+BaCO3↓;
(4)n[Ba(OH)2]=0.002mol,得到0.001molBaCO3沉淀时,有二氧化碳不足与过量两种情况,如不足,n(CO2)=n(BaCO3)=0.001mol,若过量,则n(CO2)=0.002mol+0.001mol=0.003mol,故答案为:0.001或0.003;
Ⅱ.(1)H2O2→O2的过程中,氧元素的化合价由-1价升到了0价,所以H2O2是还原剂,故答案为:H2O2;
(2)反应中Cr元素化合价降低,H2CrO4应被还原生成Cr(OH)3,故答案为:H2CrO4;Cr(OH)3;
(3)反应的方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,反应中Cr元素化合价由+6价降低为+3价,O元素化合价由-1价升高到0价,则转移电子数目和方向可表示为
 ,
,故答案为:
 ;
;(4)由反应可知,生成3molO2转移6mol电子,则转移了0.3mol电子,则产生的气体在标准状况下体积为0.15mol×22.4L/mol=3.36 L,故答案为:3.36 L.
点评:本题考查离子反应和氧化还原反应,题目难度中等,本题注意从化合价变化的角度分析氧化还原反应,易错点为I中(4)的计算,注意电子转移方向和数目的判断.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
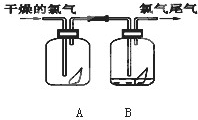 如图是探究氯气某性质的实验装置图:
如图是探究氯气某性质的实验装置图: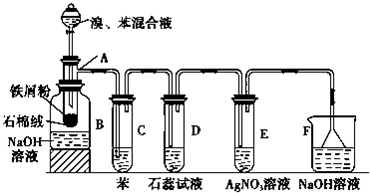

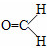
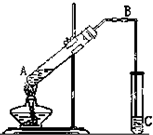 脂类化合物在日常生活中的应用越来越广泛.下图是实验制备乙酸乙酯的装置图,请填写下列空白
脂类化合物在日常生活中的应用越来越广泛.下图是实验制备乙酸乙酯的装置图,请填写下列空白