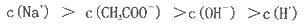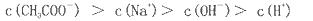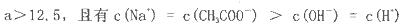题目内容
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol?L-1,向该溶液中逐滴加入0.010 mol?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- | C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
C
解析试题分析:根据溶度积规则知,析出AgCl沉淀时溶液中
c(Ag+)= Ksp(AgCl)/ c(Cl?)=1.56×10?10/0.01mol/L=1.56×10-8mol/L;析出AgBr沉淀时溶液中c(Ag+)= Ksp(AgBr)/ c(Br?)=7.7×10?13/0.01mol/L=7.7×10-11mol/L;析出Ag2CrO4沉淀时溶液中c(Ag+)=[ Ksp(Ag2CrO4)/ c(CrO42?)]1/2=3×10-5 mol/L,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-,选C。
考点:考查难溶电解质的沉淀溶解平衡。

练习册系列答案
相关题目
用相同浓度的标准盐酸滴定相同体积、相同pH的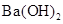 、NaOH和NH3·H2O三种碱溶液,当恰好中和时,滴定消耗盐酸的体积依序为V1、V2、V3,则V1、V2、V3三者的大小关系正确的是
、NaOH和NH3·H2O三种碱溶液,当恰好中和时,滴定消耗盐酸的体积依序为V1、V2、V3,则V1、V2、V3三者的大小关系正确的是
| A.V3>V2>V1 | B.V3=V2=V1 | C.V1=V2>V3 | D.V3>V2=V1 |
下列溶液中微粒浓度关系一定正确的是( )
| A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+) |
| C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
常温下,下列叙述正确的是( )
| A.pH值等于5的HCl溶液和PH值等于9的NaOH溶液由水电离出的C(H+)之比为1:1 |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.PH=2的HNO3溶液和PH=10的Ba(OH)2溶液等体积混合后的溶液的PH=7 |
| D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大 |
25℃时,下列溶液中水的电离程度最小的是
| A.0.01 mol/L盐酸 | B.0.01 mol/L Na2CO3溶液 |
| C.pH =" 4" NaHSO3溶液 | D.pH =11氨水 |
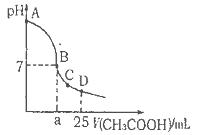
常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是
| A.若a≤b,混合液的pH一定小于7 |
| B.若a=2b,则混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.混合液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)一定成立 |
| D.当混合液的pH>7时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)一定成立 |
下列说法正确的是
| A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性 |
| C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
D.汽车尾气的净化反应2NO+2CO 2CO2+N2△H<0,则该反应一定能自发进行 2CO2+N2△H<0,则该反应一定能自发进行 |
下列叙述正确的是
| A.0.1mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等 |
| D.在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
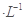 NaOH溶液中逐滴加入。0.2mol
NaOH溶液中逐滴加入。0.2mol