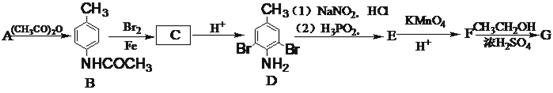题目内容
【题目】已知N元素的最低化合价是 –3价,最高化合价是+5价,那么下列物质中的N元素只具有氧化性的是( )
A.NH3B.N2C.NO2D.HNO3
【答案】D
【解析】
N元素只具有氧化性,则化合价只能降低,化合价为+5价。
A. NH3化合价为-3价,最低价,只有还原性,与题意不符,A错误;
B. N2化合价为0价,既可以升高,又可以降低,与题意不符,B错误;
C. NO2化合价为+4价,既可以升高,又可以降低,与题意不符,C错误;
D. HNO3化合价为+5价,符合题意,D正确;
答案为D。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g)![]() CH3OH(g) △H2=-90.7kJ·mol-1
CH3OH(g) △H2=-90.7kJ·mol-1
③2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3
CH3OCH3(g)+H2O(g) △H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ·mol-1、1453.0 kJ·mol-1;1mol液态水变为气态水要吸收44.0kJ的热量。反应③中的相关的化学健键能数据如表:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E/(kJ mol-1) | 436 | 343 | 465 | 453 | 413 |
则△H1=_________kJ·mol-1 △H3=_________ kJ·mol-1
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变

(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___v(逆),说明原因____________________。