题目内容
【题目】一定温度下,将3molA气体和1molB气体通入某密闭容器中,发生如下反应:![]() 。请回答下列问题:
。请回答下列问题:
(1)若容器体积固定为2L
①反应1min时测得剩余1.8mol A,C的浓度为0.4mol/L.1min内,B的平均反应速率为 ____________;x= ________
②若反应2min达到平衡,平衡时C的浓度 ______ (填“大于”“等于”或“小于”)0.8mol/L
③平衡混合物中,C的体积分数为22%,则A的转化率是 ______ ![]() 保留3位有效数字
保留3位有效数字![]()
(2)一定温度下,可逆反应:![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是 ______
在体积固定的密闭容器中反应,达到平衡状态的标志是 ______
①单位时间内生成nmolO2,同时生成2nmolNO
②用NO、O2、NO2的物质的量浓度变化表示的反应速率的比:2:1:2
③混合气体的密度不随时间的变化而变化
④O2的物质的量浓度不变
【答案】0.2mol/(Lmin) 2 小于 36.1% ④
【解析】
(1)利用三段式法计算
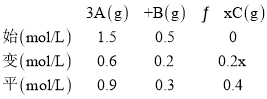
0.2x=0.4,x=2,以此解答该题;
(2)平衡标志是正逆反应速率相同,各组分含量保持不变分析选项。
(1)利用三段式法计算:

①1min内,B的平均反应速率为v(B)=![]() =0.2mol/(Lmin),0.2x=0.4,x=2;
=0.2mol/(Lmin),0.2x=0.4,x=2;
②随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,反应速率应小于1min时的速率,则1min时,C的浓度为0.4mol/L,则则平衡时C的浓度小于0.8mol/L;
③平衡混合物中,C的体积分数为22%,设转化了3xmolA,则有:

![]() ×100%=22%,x=0.361,则A的转化率是
×100%=22%,x=0.361,则A的转化率是![]() ×100%=36.1%;
×100%=36.1%;
(2)一定温度下,可逆反应:2NO(g)+O2(g)2NO2(g)在体积固定的密闭容器中反应;
①单位时间内生成n mol O2,同时生成2n mol NO,说明反应逆向进行,不能说明反应达到平衡状态,故①错误;
②用NO、O2、NO2的物质的量浓度变化表示的反应速率的比在反应过程中和平衡状态始终为2:1:2,不能说明反应达到平衡状态,故②错误;
③反应前后气体质量和体积始终不变,混合气体的密度不随时间的变化而变化,不能说明反应达到平衡状态,故③错误;
④O2的物质的量浓度不变是平衡标志,故④正确;
故答案为④。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案