题目内容
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、CaO、SiO2)为原料生产ZnSO4·7H2O的流程如图:
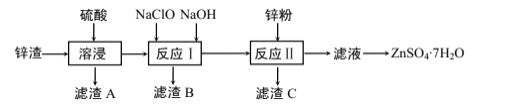
(1)“滤渣A”的主要成分是__。
(2) “反应Ⅰ”中,先加入NaClO反应的离子方程式为__。
(3) “反应Ⅰ”中,再加入NaOH调节合适的pH,则“滤渣B”的主要成分是__(填化学式)。
(4) “反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是__。
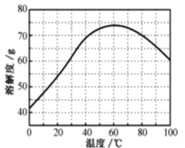
(5)已知ZnSO4溶液的溶解度随温度变化如图,从“滤液”中分离出ZnSO4·7H2O,涉及以下操作:a.在60℃蒸发溶剂;b.蒸发至溶液出现晶膜,停止加热;c.在100℃蒸发溶剂;d.冷却至室温;e.过滤。以上操作的正确顺序为:__(操作可重复使用)。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为___(填字母标号)。
a.ZnSO4·H2O b.ZnSO4c.Zn3O(SO4)2d.ZnO
【答案】SiO2、CaSO4 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O Fe(OH)3 除去锌粉表面的氧化膜 cbabde c
【解析】
工业上往锌渣(主要成分为ZnO、FeO、CuO、CaO、SiO2)中加入硫酸,ZnO、FeO、CuO完全溶解转化为硫酸盐,CaO与硫酸反应转化为CaSO4沉淀,SiO2不反应,CaSO4、SiO2成为滤渣A;往滤液中加入NaClO,此时Fe2+被氧化为Fe3+,再加入NaOH溶液,Fe3+转化为Fe(OH)3,并成为滤渣B;再往滤液中加入锌粉,将溶液中的Cu2+还原为Cu;滤液经过蒸发结晶,便得到ZnSO4·7H2O晶体。
(1)由以上分析知,“滤渣A”的主要成分是SiO2、CaSO4;答案为:SiO2、CaSO4;
(2) “反应Ⅰ”中,先加入NaClO,将Fe2+氧化为Fe3+,此时溶液呈酸性,ClO-被还原为Cl-,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(3) “反应Ⅰ”中,再加入NaOH调节合适的pH,此时Fe3+与OH-反应生成Fe(OH)3,则“滤渣B”的主要成分是Fe(OH)3;答案为:Fe(OH)3;
(4) “反应Ⅱ”中,发生的是Zn与Cu2+的置换反应,加入的锌粉需用少量稀硫酸处理,则稀硫酸应处理锌,以有利于锌与Cu2+的反应,原因是除去锌粉表面的氧化膜;答案为:除去锌粉表面的氧化膜;
(5)从图中可以看出,60℃前,ZnSO4的溶解度随温度升高而增大,60℃后,ZnSO4的溶解度随温度升高而减小。为便于蒸发水分,起初温度应控制在100℃,加热蒸发到溶液饱和时,再降温至60℃,再次蒸发水分,至饱和后,降低温度,获得晶体。由此可确定以上操作的正确顺序为:cbabde;答案为:cbabde;
(6)28.7g ZnSO4·7H2O,物质的量为![]() =0.1mol,100℃时,固体物质的摩尔质量为
=0.1mol,100℃时,固体物质的摩尔质量为![]() =179g/mol,其为ZnSO4·H2O;250℃时,固体物质的摩尔质量为
=179g/mol,其为ZnSO4·H2O;250℃时,固体物质的摩尔质量为![]() =161g/mol,其为ZnSO4;930℃时,固体物质的摩尔质量为
=161g/mol,其为ZnSO4;930℃时,固体物质的摩尔质量为![]() =81g/mol,其为ZnO;所以680℃时,固体为Zn3O(SO4)2;答案为:Zn3O(SO4)2。
=81g/mol,其为ZnO;所以680℃时,固体为Zn3O(SO4)2;答案为:Zn3O(SO4)2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案