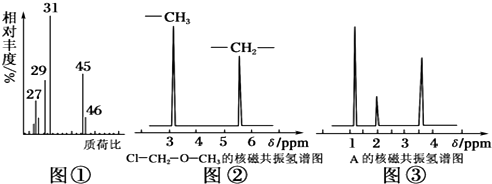
题目内容
15.下列反应方程式中不属于氧化还原反应的是( )| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | Zn+2HCl═ZnCl2+H2↑ | ||
| C. | 2O3$\frac{\underline{\;催化剂\;}}{\;}$3 O2 | D. | CuO+H2$\frac{\underline{\;高温\;}}{\;}$Cu+H2O |
分析 发生的反应中,含元素的化合价变化,则为氧化还原反应;若不含元素的化合价变化,则不属于氧化还原反应,以此来解答.
解答 解:A.镁和氧气反应生成氧化镁,Mg、O元素的化合价变化,为氧化还原反应,故A不选;
B.反应生成氯化锌和氢气,Zn、H元素的化合价变化,为氧化还原反应,故B不选;
C.臭氧转变成氧气,没有元素的化合价变化,不属于氧化还原反应,故C选;
D.反应生成Cu和水,Cu、H元素的化合价变化,为氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答关键,侧重氧化还原反应判断的考查,题目难度不大.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
5.如图所示的装置最适宜于干燥、收集的气体是( )

| A. | NH3 | B. | HCl | C. | CO2 | D. | SO2 |
3.下列烃在光照下与氯气反应,生成三种一氯代物的有( )
| A. | 2-甲基丙烷 | B. | 异戊烷 | C. | 2,2-二甲基丁烷 | D. | 2,3-二甲基丁烷 |
7.关于醋酸溶液下列叙述错误的是( )
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 升高温度,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值增大 | |
| C. | CH3COOH溶液中加少量的CH3COONa固体,醋酸的电离平衡逆向移动 | |
| D. | 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
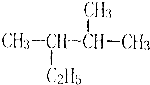 ①2,3一二甲基戊烷;
①2,3一二甲基戊烷;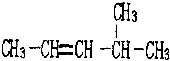 ②4-甲基-2-戊烯.
②4-甲基-2-戊烯.