题目内容
10.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;R与X同主族;Q是地壳中含量最高的非金属元素.请回答:(1)Y、Z、Q三种元素第一电离能由大到小的顺序是(写元素符号)N>O>C
(2)将过量Z的气态氢化物通入硫酸铜溶液中,总反应的离子方程式为Cu2++4NH3=[Cu(NH3)4]2+.
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A$?_{D}^{C}$B(在水溶液中进行),其中C是溶于水显酸性的气体;D是淡黄色固体.
①写出C的结构式_O=C=O;D的电子式_

②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.用离子方程式表示A溶液显碱性的原因_CO32-+H2O?HCO3-+OH-.A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
分析 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.Q是地壳中含量最高的非金属元素,则Q为O元素;X、Y两元素最高正价与最低负价之和均为0,且R与X同主族,结合原子序数可知X、R处于ⅠA族,Y处于ⅣA族,故X为氢元素,R为Na元素,Y为C元素,Z的原子序数介于碳、氧之间,故Z为N元素,据此解答.
解答 解:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.Q是地壳中含量最高的非金属元素,则Q为O元素;X、Y两元素最高正价与最低负价之和均为0,且R与X同主族,结合原子序数可知X、R处于ⅠA族,Y处于ⅣA族,故X为氢元素,R为Na元素,Y为C元素,Z的原子序数介于碳、氧之间,故Z为N元素.
(1)同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,
故答案为:N>O>C;
(2)Z的气态氢化物为NH3,将过量氨气通入硫酸铜溶液中,总反应离子方程式为:Cu2++4NH3=[Cu(NH3)4]2+,
故答案为:Cu2++4NH3=[Cu(NH3)4]2+;
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A$?_{D}^{C}$B(在水溶液中进行),其中,C是溶于水显酸性的气体,则C为CO2,D是淡黄色固体则D为Na2O2,则:
①CO2的结构式为O=C=O,Na2O2的电子式为 ,
,
故答案为:O=C=O; ;
;
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,结合转化关系可知,A为碳酸钠、B为碳酸氢钠,溶液中碳酸根水解CO32-+H2O?HCO3-+OH-,破坏水的电离平衡,溶液呈碱性;
碳酸钠、碳酸氢钠均为0.1mol•L-1的混合溶液中,钠离子浓度最大,碳酸根、碳酸氢根水解,溶液呈碱性,碳酸根的水解程度大于碳酸氢根,故离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
故答案为:CO32-+H2O?HCO3-+OH-;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查结构性质位置关系、常用化学用语、无机推断、盐类水解等,难度中等,推断元素是解题关键,需要学生熟练掌握元素化合物知识.

( )
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 | |
| C. | 由Na2O中阴阳离子个数比为1:2,可推出Na2O2中阴阳离子个数比为 1:1 | |
| D. | 由“2Fe+3Br2=2FeBr3”反应可推出“2Fe+3I2=2FeI3”反应也能发生 |
| A. | 甲烷和乙烷 | B. | 乙炔和丙烯 | C. | 乙烷和乙烯 | D. | 丁炔和乙烯 |
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物是HClO4,碱性最强的化合物是KOH;(填化学式 )
(3)用电子式表示元素④与⑥的化合物的形成过程:
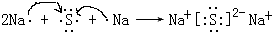 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)表示①与⑦的化合物的电子式
 ,该化合物含的共价键类型是极性共价键.
,该化合物含的共价键类型是极性共价键. | A. | 第ⅠA族元素铯的两种位素${\;}_{\;}^{137}$Cs比${\;}_{\;}^{133}$Cs多4个质子 | |
| B. | 第ⅦA族元素从上到下,其氢化物的还原性逐渐减弱 | |
| C. | 同主族元素原子半径越大,单质的熔点越高 | |
| D. | 同周期元素(除0族元素外)从左到右,简单阴离子半径逐渐减小 |
| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | Zn+2HCl═ZnCl2+H2↑ | ||
| C. | 2O3$\frac{\underline{\;催化剂\;}}{\;}$3 O2 | D. | CuO+H2$\frac{\underline{\;高温\;}}{\;}$Cu+H2O |
| A. | PCl3(l)+Cl2(g)?PCl5(s) 降温,PCl3转化率增大 | |
| B. | NO2(g)+SO2(g)?NO(g)+SO3(g) 降温,SO3的体积分数增加 | |
| C. | 2NO2(g)?2NO(g)+O2(g) 降温,颜色加深 | |
| D. | CS2(l)+2H2O(g)?CO2(g)+2H2S(g) 升温,CO2的平衡浓度增大 |
| A. | O2、O3 | B. | H2O、D2O | C. | H、D | D. | 1944K、2040Ca |