题目内容
3.下列物质中:A.氢氧化钠、B.二氧化硅、C.金刚石、D.氯化钠、E.白磷、F.干冰、G.晶体硅、H.氧化镁、I.晶体氩 (填代号)(1)属于原子晶体的化合物是B
(2)属于分子晶体的化合物是F
(3)含共价键的离子晶体是A.
分析 (1)常见的原子晶体有:一些非金属单质,如金刚石、硼、硅、锗等;一些非金属化合物,如二氧化硅、碳化硅、氮化硼等;
(2)常见的分子晶体有:一些非金属单质,如白磷、硫磺和气体单质;一些非金属氧化物,如二氧化碳、二氧化硫等;
(3)含共价键的离子晶体是离子化合物,但其中含共价键.
解答 解:A.NaOH是离子化合物,其中既含共价键又含离子键,属于离子晶体;
B.二氧化硅是原子晶体,只含共价键;
C.金刚石是单质,为原子晶体;
D.NaCl是离子晶体,只含离子键;
E.P4是分子晶体,分子内只含共价键,分子间为分子间作用力;
F.干冰即CO2,为分子晶体,分子内只含共价键,分子间为分子间作用力;
G.晶体硅Si是原子晶体,原子间以共价键结合;
H.氧化镁MgO是离子晶体,只含离子键;
I.晶体氩Ar是分子晶体,由于是单原子分子,故分子内无任何化学键,分子间有分子间作用力.
(1)属于原子晶体的化合物是B,故答案为:B;
(2)属于分子晶体的化合物是F,故答案为:F;
(3)含共价键的离子晶体是A,故答案为:A.
点评 本题考查晶体类型的判断、化学键类型的判断等,难度不大,注意知识的积累.

练习册系列答案
相关题目
13.质量相同的铝粉和足量的盐酸、足量的NaOH溶液完全反应,在同温同压下生成气体的体积比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 1:4 |
14.现有部分短周期元素的性质或原子结构如表:下列叙述正确的是( )
| 元素代号 | 元素性质或原子结构 |
| T | M层上的电子数为6个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7 |
| A. | 元素X的一种同位素可测定文物年代,这种同位素的符号是12C | |
| B. | 元素Z的非金属性比元素T弱 | |
| C. | Y和T位于同一主族 | |
| D. | T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其它三种的是碳酸 |
11.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢溶于水 | B. | 氯化铵受热分解 | C. | 干冰升华 | D. | 氯化钠熔化 |
18.研究人员最近发现了一种“水电池”,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池总反应式为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,下列对“水电池”在海水中放电时的有关说法正确的是( )
| A. | 正极反应式为:5MnO2+2e-═Mn5O102- | |
| B. | 每生成1 mol AgCl转移2 mol电子 | |
| C. | 工作时,电子由MnO2极经外电路流向Ag极 | |
| D. | Ag发生还原反应 |
15.四种主族元素的离子aX2+,bY+,cZ-和dR2-(a,b,c,d为元素的原子序数),它们具有相同的电子层结构,对下列叙述的判断正确的是( )
①c-b=2 ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y.
①c-b=2 ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y.
| A. | ②③正确 | B. | 只有③正确 | C. | ①②③④正确 | D. | ①②③正确 |
12.下列除杂的有关操作和试剂均正确的是( )
| 组别 | 被提纯物质 | 杂质 | 除杂试剂 | 除杂操作 |
| A | CO2 | SO2 | Na2CO3溶液 | 洗气 |
| B | 乙酸乙酯 | 乙酸 | 乙醇和浓H2SO4 | 加热 |
| C | 乙烷 | 乙烯 | 溴水、碱石灰 | 洗气 |
| D | 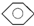 | CH3CH2OH | H2O | 分液 |
| A. | A | B. | B | C. | C | D. | D |
 .
.