题目内容
【题目】下列状态的物质,既能导电又属于电解质的是( )
A.氯化镁晶体B.熔融氢氧化钾C.铜D.氯化钠溶液
【答案】B
【解析】
A、氯化镁晶体是电解质,但是镁离子和氯离子受离子键的作用,不能自由移动,氯化镁晶体不导电,故A错误;
B、熔融氢氧化钾,发生了电离,可以导电,属于电解质,故B正确;
C、铜属于金属单质,含自由电子,能导电,单质不属于电解质,故C错误;
D、氯化钠溶液含有自由移动的离子,可以导电,属于混合物,不属于电解质,故D错误;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据题意回答下列问题:
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55molL﹣1 , 盐酸的浓度为0.5molL﹣1 , 每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2﹣t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(1)已知盐酸、NaOH溶液密度近似为1.00gcm﹣3 , 中和后混合液的比热容c=4.18×10﹣3kJg﹣1℃﹣1 , 则该反应的中和热为△H= .
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会(填“偏大”、“偏小”或“不变”),其原因是 .
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热(填“偏大”、“偏小”或“不变”).
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
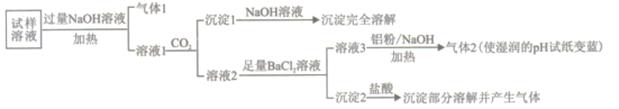
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。



