题目内容
1.氧元素在地壳中的含量最多.下列关于${\;}_{8}^{18}$O的说法中,正确的是( )| A. | 质子数为18 | B. | 中子数为18 | C. | 电子数为18 | D. | 质量数为18 |
分析 元素符号左上角数字表示质量数、左下角数字表示质子数,所以该核素中质子数是8、质量数是18,中子数=质量数-质子数,原子中核外电子数等于质子数,据此分析解答.
解答 解:元素符号左上角数字表示质量数、左下角数字表示质子数,所以该核素中质子数是8、质量数是18,中子数=质量数-质子数=18-8=10,原子中核外电子数等于质子数=8,
A.质子数是8,故A错误;
B.中子数是10,故B错误;
C.电子数是8,故C错误;
D.质量数是18,故D正确;
故选D.
点评 本题考查质子数、中子数、质量数、核外电子数之间的关系,明确这几个物理量之间的关系即可解答,知道元素符号周围各个方向上数字的含义,题目难度不大.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 1L 1 mol/L的盐酸中所含微粒总数约为2×6.02×1023个 | |
| B. | NaHS溶液中HS-的水解方程式为:HS-+H2O?S2-+H3O+ | |
| C. | A(s)=B(s)+C(g)△H=+86 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | 由水电离出的c(H+)=10-13mol/L的溶液中可能含有:Fe2+、K+、CO32-、NO3- |
19.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y位于元素周期表第第三周期ⅥA族族,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写化学式).
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W2Y在空气中煅烧生成W2O的化学方程式是2Cu2S+3O2$\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2.
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.已知:此反应的化学方程式是2CO+SO2$\frac{\underline{\;催化剂\;}}{\;}$S+2CO2.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W2Y在空气中煅烧生成W2O的化学方程式是2Cu2S+3O2$\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2.
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.已知:此反应的化学方程式是2CO+SO2$\frac{\underline{\;催化剂\;}}{\;}$S+2CO2.
16.用NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 82gNa218O2固体与足量的CO2反应转移电子数为NA | |
| B. | 0.1mol Mg在空气中完全燃烧生成氧化镁和二氮化三镁,转移电子数为0.2NA | |
| C. | 标准状况下,11.2L乙醇完全燃烧产生的CO2分子数NA | |
| D. | 1molCnH2n+2中含有的共价键数为(3n+1)NA |
10.下列装置用于海水中提取镁,能达到实验目的是( )
| A. |  煅烧石灰石 煅烧石灰石 | B. | 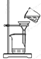 氢氧化镁沉淀过滤 | ||
| C. | 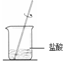 氢氧化镁固体溶解 | D. |  氯化镁晶体制氯化镁 氯化镁晶体制氯化镁 |
 回答下列问题
回答下列问题
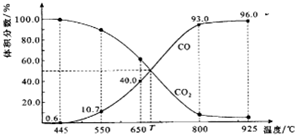 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示: 已知A、B、C、D、E都是元素周期表中前36号元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与p电子数相等,C在元素周期表的各元素中电负性最大,D原子基态时最外层成对电子对数是单电子数的3倍,E原子基态时未成对电子数是同周期元素中最多的.
已知A、B、C、D、E都是元素周期表中前36号元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与p电子数相等,C在元素周期表的各元素中电负性最大,D原子基态时最外层成对电子对数是单电子数的3倍,E原子基态时未成对电子数是同周期元素中最多的. ,1mol A22-中含有的π键数目为2NA
,1mol A22-中含有的π键数目为2NA ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧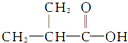 ⑨CH3CHBrCH3 ⑩
⑨CH3CHBrCH3 ⑩ ⑪
⑪