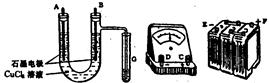
题目内容
有一硝酸盐晶体,其化学式为M(NO3)x?yH2O,相对分子质量为242.取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出.经称量阴极增重0.32g.求:
(1)金属M的相对原子质量及x、y值.
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)
(1)金属M的相对原子质量及x、y值.
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)
(1)n(M)=n[M(NO3)x?yH2O]=
=0.005mol;
当有0.01mol电子发生转移时,溶液中金属全部析出.经称量阴极增重0.32g;
Ar(M)=
=64;
M的化合价=
=2;
所以x=2
根据64+2(14+48)+18y=242
得y=3
答:金属M的相对原子质量为64,x为+2、y为3;
(2)电解总反应为2M(NO3)2+2H2O
2M+4HNO3+O2↑,0.01mol电子转移,溶液中氢离子增加和氢氧根离子减小相同,依据电极反应计算得到,4OH--4e-=2H2O+O2↑,反应过程中氢氧根离子减小0.01mol目前溶液中增加氢离子物质的量为0.01mol,氢离子浓度=
=0.1mol/L,溶液pH=1,
答:电解后溶液的pH为1.
| 1.21g |
| 242g/mol |
当有0.01mol电子发生转移时,溶液中金属全部析出.经称量阴极增重0.32g;
Ar(M)=
| 0.32 |
| 0.005 |
M的化合价=
| 0.01mol |
| 0.005mol |
所以x=2
根据64+2(14+48)+18y=242
得y=3
答:金属M的相对原子质量为64,x为+2、y为3;
(2)电解总反应为2M(NO3)2+2H2O
| ||
| 0.01mol |
| 0.1L |
答:电解后溶液的pH为1.

练习册系列答案
相关题目