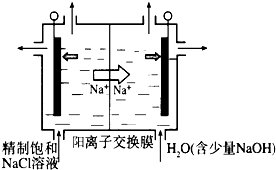
题目内容
电解含有重水(D2O)的普通水时,在两极共收集到气体18.5g,其体积恰好是33.6L(标准状况).这些气体中普通氢和重氢(D)的原子个数比为( )
| A.1:1 | B.2:1 | C.3:1 | D.4:1 |
电解水的方程式为2H2O
2H2↑+O2↑,由方程式知,氢气和氧气的体积之比为2:1,
即氢气的体积为22.4L,氢气的物质的量为1mol;氧气的体积为11.2L,氧气的质量=
×32g/mol=16g;
氢气的质量为2.5g,所以氢气的平均摩尔质量=
=2.5g/mol,普通氢和重氢的物质的量之比为: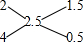 1.5:0.5=3:1,
1.5:0.5=3:1,
普通氢和重氢都是双原子分子,所以普通氢和重氢的原子个数之比为3:1,故选C.
| ||
即氢气的体积为22.4L,氢气的物质的量为1mol;氧气的体积为11.2L,氧气的质量=
| 11.2L |
| 22.4L/mol |
氢气的质量为2.5g,所以氢气的平均摩尔质量=
| 2.5g |
| 1mol |
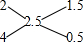 1.5:0.5=3:1,
1.5:0.5=3:1,普通氢和重氢都是双原子分子,所以普通氢和重氢的原子个数之比为3:1,故选C.

练习册系列答案
相关题目
 产。下列说法中正确的是
产。下列说法中正确的是