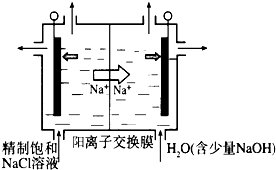
题目内容
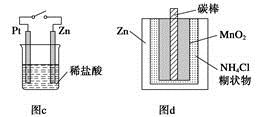
某同学按如图所示的装置进行电解实验.下列说法正确的是( )
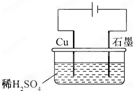

| A.电解过程中,铜电极上有H2产生 | ||||
B.电解初期,主反应方程式为:Cu+H2SO4
| ||||
| C.电解一定时间后,石墨电极上有铜析出 | ||||
| D.整个电解过程中,H+的浓度不断增大 |
A、铜电极和电源正极相连做电解池阳极,铜失电子发生氧化反应,电极 反应Cu-2e-=Cu2+,铜电极无氢气生成,故A错误;
B、电解原理分析,铜失电子生成铜离子,硫酸溶液中氢离子在阴极得到电子生成氢气,电解初期,主反应方程式为:Cu+H2SO4
CuSO4+H2↑,故B正确;
C、阳离子移向阴极,所以阳极生成的铜离子会移向阴极,由于铜离子氧化性大于氢离子,所以在阴极得到电子生成铜,故C正确;
D、活性电极必然被氧化,H+在阴极放电,变成H2放出..H+会减少,故D错误;
故选BC.
B、电解原理分析,铜失电子生成铜离子,硫酸溶液中氢离子在阴极得到电子生成氢气,电解初期,主反应方程式为:Cu+H2SO4
| ||
C、阳离子移向阴极,所以阳极生成的铜离子会移向阴极,由于铜离子氧化性大于氢离子,所以在阴极得到电子生成铜,故C正确;
D、活性电极必然被氧化,H+在阴极放电,变成H2放出..H+会减少,故D错误;
故选BC.

练习册系列答案
相关题目
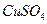 溶液时,通电一段时间后,向所得的溶液中加入0.1mol
溶液时,通电一段时间后,向所得的溶液中加入0.1mol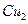 (
(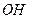 )
)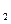
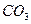 后恰好恢复到点解前的浓度和
后恰好恢复到点解前的浓度和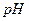 (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为
(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为