题目内容
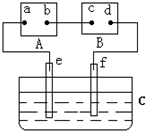
如图:通电5min后,电极5质量增加2.16g,试回答:
(1)1是______极.
(2)若A池溶液体积为200mL(设电解过程中溶液体积不变),则电解后,溶液pH为多少?______
(3)若B槽中共收集到标况224mL气体,且溶液体积为200mL(设电解过程中溶液体积不变),则通电前溶液中的Cu2+物质的量浓度为多少?______.

(1)1是______极.
(2)若A池溶液体积为200mL(设电解过程中溶液体积不变),则电解后,溶液pH为多少?______
(3)若B槽中共收集到标况224mL气体,且溶液体积为200mL(设电解过程中溶液体积不变),则通电前溶液中的Cu2+物质的量浓度为多少?______.

(1)A、B、C装置有外接电源,所以是电解池,通电5min后,电极5质量增加2.16g,说明电极5是阴极,得电子析出金属单质,所以a是电源的负极,b是电源的正极,与电源负极相连的电极为阴极,所以1是阴极,
故答案为:阴;
(2)通电5min后,电极5质量增加2.16g,电极5上析出的金属是银,银的物质的量=
=0.02mol,转移电子的物质的量=0.02mol×1=0.02mol,A电池中电池反应式为2NaCl+2H2O
H2↑+Cl2↑+2NaOH,设反应中生成氢氧化钠的物质的量为x,
2NaCl+2H2O
H2↑+2NaOH+Cl2↑ 转移电子
2mol2mol
x0.02mol x=0.02mol
C(NaOH)=
=0.1mol/L,所以溶液的PH=13,
故答案为:13;
(3)通电5min后,电极5质量增加2.16g,电极5上析出的金属是银,银的物质的量=
=0.02mol,转移电子的物质的量=0.02mol×1=0.02mol.B电池中阳极上通过0.02mol电子时生成氧气的体积=
×22.4L/mol=112mL,B中共收集气体的体积是224mL,所以气体中还有氢气,氢气的体积是112mL,生成112mL氢气转移电子的物质的量=
×2=0.01mol电子,一共转移电子的物质的量是0.02mol,所以生成铜转移电子的物质的量=0.01mol,n(Cu)=
=0.005mol,C(Cu2+)=
=0.025mol/L,
故答案为:0.025mol/L;
故答案为:阴;
(2)通电5min后,电极5质量增加2.16g,电极5上析出的金属是银,银的物质的量=
| 2.16g |
| 108g/mol |
| ||
2NaCl+2H2O
| ||
2mol2mol
x0.02mol x=0.02mol
C(NaOH)=
| 0.02mol |
| 0.2L |
故答案为:13;
(3)通电5min后,电极5质量增加2.16g,电极5上析出的金属是银,银的物质的量=
| 2.16g |
| 108g/mol |
| 0.02mol |
| 4 |
| 0.112L |
| 22.4L/mol |
| 0.01mol |
| 2 |
| 0.005mol |
| 0.2L |
故答案为:0.025mol/L;

练习册系列答案
相关题目