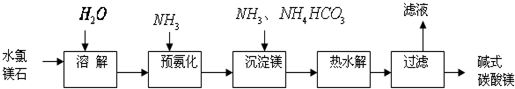
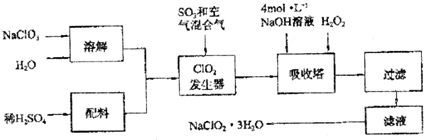
题目内容
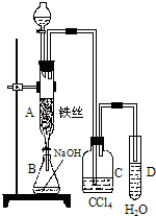
17.利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下: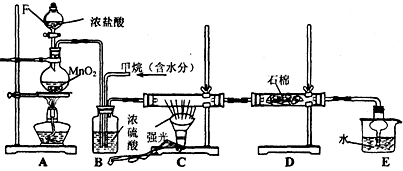
根据要求填空:
(1)实验室制取Cl2的离子反应方程式为:MnO2+4H++2Cl- $\frac{\underline{\;△\;}}{\;}$ Mn2++Cl2↑+2H2O
(2)E装置的作用是CD(填编号);
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(3)B装置有三种功能:①干燥气体;②将气体混合均匀;③控制气体流速
(4)D装置中的石棉上吸附着KI饱和溶液及KI粉末,其作用是除去过量的氯气
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为分液.
分析 实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,Cl2经浓硫酸干燥后和甲烷在强光照条件下发生取代反应,生成多种氯代烃和HCl,如在强光照射下可发生CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl,D装置中的石棉上吸附着KI饱和溶液及KI粉末,其作用是除去过量的氯气,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离.
(1)实验室制取Cl2,二氧化锰与浓盐酸在加热条件反应生成氯化锰、氯气和水,盐酸、氯化锰可拆写成离子;
(2)反应后剩余的氯化氢气体能够污染空气,不能排放到空气中,需要吸收,氯化氢易溶于水需要放倒吸;
(3)浓硫酸可以干燥氯气和氯化氢,根据冒出气泡的速率来控制气体硫酸;
(4)氯气能将碘化钾氧化为碘单质,D装置其作用是除去过量的氯气;
(5)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离.
解答 解:(1)MnO2和HCl(浓)在加热时生成MnCl2和Cl2、H2O,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,盐酸、氯化锰可拆写成离子,离子反应为:MnO2+4H++2Cl- $\frac{\underline{\;△\;}}{\;}$ Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;△\;}}{\;}$ Mn2++Cl2↑+2H2O;
(2)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸,E装置在吸收氯化氢时可防止倒吸,
故答案为:CD;
(2)生成的氯气中含有水,因浓硫酸具有吸水性,具有干燥作用,B装置除:①干燥气体;②将气体混合均匀之外,还具有通过气泡的多少来控制气体的流速,
故答案为:控制气体流速;
(4)氯气能将碘化钾氧化为碘单质,KI饱和溶液及KI粉末可除去过量的氯气,
故答案为:除去过量的氯气;
(5)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;其中一氯甲烷为气态,二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;
故答案为:分液.
点评 本题考查了物质制备和性质实验设计,主要考查了氯气的制备以及甲烷与氯气的取代反应,题目难度中等,侧重于考查学生的实验探究能力和对基础知识的综合应用能力.

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案(1)pH相等的H2SO4和HClO与足量的强碱反应,HClO消耗的强碱体积大
(2)100℃,NaClO溶液的pH=7
(3)NaClO溶液中有HClO分子存在
(4)HClO溶液有很强的氧化性
(5)等体积,等物质的量浓度的HClO与NaOH溶液恰好完全反应
(6)盐酸与KClO溶液反应,生成HClO.
| A. | (1)(2)(3) | B. | (1)(3)(4)(6) | C. | (1)(2)(5)(6) | D. | (1)(2)(3)(6) |
| A. | 2.00 | B. | 1.30 | C. | 4.00 | D. | 5.00 |
| A. | 2min时,M的物质的量浓度为0.6mol•L-1 | |
| B. | 4min时,用E表示的反应速率为0.2mol•L-1•min-1 | |
| C. | 4min后,向容器中充入不参与反应的稀有气体,M的物质的量不变 | |
| D. | 4min时,M的转化率为80% |