题目内容
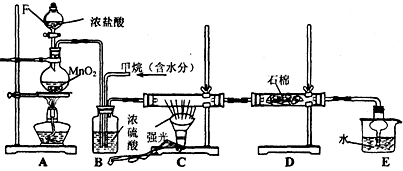
7.铁在自然界存在广泛,在工业、农业和国防科技中有重要应用.(1)用铁矿石(赤铁矿)冶炼生铁的原料中除铁矿石和焦炭外还有石灰石,写出石灰石除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;
高炉排出气体的主要成分有N2、CO2和CO(填化学式).
(2)铁矿石中常含有硫,使高炉气中混有SO2污染空气.工业脱SO2的方法可以用ac.(填字母序号)
a.氨水 b.浓硫酸 e.氢氧化钠溶液 d.稀硝酸
(3)配制的FeCl2溶液中会含有少量FeCl3,检验FeCl3常用的试剂是硫氰酸钾溶液(填试剂的名称).欲除去其中的FeCl3,应在该FeCl2溶液加入铁粉.
分析 (1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙;加入焦炭,先生成CO,最后生成二氧化碳;
(2)高炉气中混有SO2,SO2为酸性气体,可与碱反应;由于二氧化硫与稀硝酸的反应中有NO生成,所以不能使用稀硝酸;
(3)Fe3+能和SCN-生成络合物,使溶液呈现血红色,据此可检验铁离子;铁离子能够与铁粉反应生成亚铁离子,据此可除去氯化铁.
解答 解:(1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙,涉及反应有CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3
,加入焦炭,先生成CO,最后生成二氧化碳,尾气中含有CO,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;CO;
(2)高炉气中混有SO2,SO2为酸性气体,可与碱反应,可用碱液或氢氧化钠、氨水等吸收,所以a、c正确;
由于稀硝酸与二氧化硫的反应中有NO生成,所以不能使用稀硝酸;
浓硫酸不与二氧化硫反应,故不能使用浓硫酸;
故答案为:ac;
(3)Fe3+能和SCN-生成络合物,使溶液呈现血红色,这一反应是Fe3+的特征反应,可检验配制的FeCl2溶液中是否含有少量FeCl3,所以选用的试剂为硫氰酸钾溶液;
因为铁离子能和铁反应生成亚铁离子,化学方程式为:2FeCl3+Fe═3FeCl2,故可用铁除去FeCl2溶液中的少量氯化铁,
故答案为:硫氰酸钾溶液;铁粉.
点评 本题考查了二氧化硫的污染及治理、铁离子的检验,题目难度中等,明确二氧化硫的性质、铁离子的检验方法为解答关键,试题培养了学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | NaCN中碳元素的化合价为+4 | |
| B. | NaCN易溶于水,其水溶液呈碱性 | |
| C. | 可用强氧化剂如H2O2等将NaCN氧化为无毒物质 | |
| D. | 为防止中毒,须加强对地表水、排海口等的氰化物排查 |
| A. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| B. | 将③、④分别稀释到pH=5,由水电离出氢离子的浓度均减小100倍 | |
| C. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)<1 |
| 操 作 | 现 象 | 结 论 | |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| C | 向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或HCO3- |
| D | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 若A为单一气体,则不是甲烷就是乙烯 | |
| B. | 若A为单一气体,则可能是丙烷 | |
| C. | 若A为混合气体,则可能是甲烷,丙烯,乙炔按体积比2:1:1混合而成 | |
| D. | 若A为混合气体,则可能是乙烯,乙烷按质量比14:22混合而成室温时 |
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH${\;}_{4}^{+}$)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
 $\stackrel{合适的氧化剂}{→}$
$\stackrel{合适的氧化剂}{→}$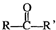 (注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
(注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
 .
. 或
或 .
.