题目内容
19.用CH4催化还原NOx可以消除氮氧化物的污染.例如:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列说法不正确的是( )
| A. | 若用标准状况下4.48L CH4还原NO2生成N2和水蒸气,放出的热量为173.4kJ | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574kJ•mol-1 | |
| C. | 反应①②转移的电子数相同 | |
| D. | 反应②中当4.48L(标准状况)CH4反应完全时转移的电子的物质的量为1.6mol |
分析 A、根据反应①②,利用盖斯定律结合热化学方程式系数的意义来回答;
B、气态水转变为液态水要放热;
C、根据化合价升高数=化合价降低数=转移电子数来回答;
D、根据化合价升高数=化合价降低数=转移电子数来回答.
解答 解:A、由反应①②,利用盖斯定律,反应CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)可以是$\frac{1}{2}$(①+②)得到,所以该反应的△H=-867kJ•mol-1,即4.48L(0.2mol)CH4 还原NO2至N2,放出的热量为173.4kJ,故A正确;
B、因为气态水转变为液态水要放热,所以由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H<-574kJ•mol-1,故B错误;
C、反应①②转移的电子数=化合价升高数=化合价降低数=8,转移电子相同,故C正确;
D、反应CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)转移电子数是8mol,4.48L(0.2mol)CH4还原NO2至N2,整个过程中转移的电子总数为1.6mol,故D正确;
故选B.
点评 本题考查学生热化学方程式的含义以及化学方程式电子转移知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
9.已知5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 反应中KCl被还原 |
10.实验中发生如下事故,处理方法正确的是( )
| A. | 少量浓硫酸溅在皮肤上,立即用NaOH溶液冲洗 | |
| B. | 酒精洒在桌面上引起失火,可用水浇灭 | |
| C. | 轻度烧伤、烫伤可用冰水或者冷水降温止痛 | |
| D. | 误服可溶性钡盐,可及时服用Na2CO3溶液解毒 |
11.美国UNC化学教授Thomas J.Meyer等研发了安全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物.已知10mL Na2R溶液含Na+的数目为N个,该Na2R溶液的物质的量浓度为( )
| A. | N×10-2 mol/L | B. | $\frac{N}{1.204×1022}$ mol/L | ||
| C. | $\frac{N}{6.02×1021}$mol/L | D. | $\frac{N}{6.02×1025}$mol/L |
8.将某200ml MgCl2、K2SO4、(NH4)2SO4的混合溶液分成两等份,取一份加入含a mol氯化钡溶液,刚好使硫酸根沉淀完全,继续加入含b mol硝酸银溶液,刚好使氯离子沉淀完全,另取一份加入含c mol氢氧化钠的溶液,恰好完全反应,则该溶液中的钾离子的浓度为( )
| A. | 10(b+2a-c) | B. | (2b-c):0.3 | C. | (2b-a+c):0.3 | D. | 10(b-c) |
9.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1)
用符号“>”“<”“=”或数字填空:
(1)α1+α2=1.
(2)a+b=92.4.
(3)2c1<c3
(4)2p2>p3
(5)α1+α3=<1.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2,3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
(1)α1+α2=1.
(2)a+b=92.4.
(3)2c1<c3
(4)2p2>p3
(5)α1+α3=<1.
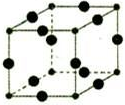 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用. .
.