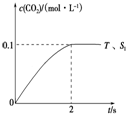
题目内容
8.将某200ml MgCl2、K2SO4、(NH4)2SO4的混合溶液分成两等份,取一份加入含a mol氯化钡溶液,刚好使硫酸根沉淀完全,继续加入含b mol硝酸银溶液,刚好使氯离子沉淀完全,另取一份加入含c mol氢氧化钠的溶液,恰好完全反应,则该溶液中的钾离子的浓度为( )| A. | 10(b+2a-c) | B. | (2b-c):0.3 | C. | (2b-a+c):0.3 | D. | 10(b-c) |
分析 将某200ml MgCl2、K2SO4、(NH4)2SO4的混合溶液分成两等份,则每一份溶液的体积为100mL.
取一份加入含a mol氯化钡溶液,刚好使硫酸根沉淀完全,根据Ba2++SO42-=BaSO4↓可知,溶液中的n(SO42-);a mol氯化钡向溶液中引入2amolCl-,继续加入含b mol硝酸银溶液,刚好使氯离子沉淀完全,则能求出原溶液中Cl-的物质的量,从而求出氯化镁的物质的量;
另取一份加入含c mol氢氧化钠的溶液,恰好完全反应,而Mg2+和NH4+均能消耗OH-,根据根据消耗的氢氧化钠的物质的量和镁离子的物质的量,即能求出NH4+的物质的量,从而求出(NH4)2SO4的物质的量,然后根据n(SO42-)的物质的量,从而能求出K2SO4的物质的量,继而能求出钾离子的物质的量,结合溶液的体积为100mL,故能求出钾离子的浓度.
解答 解:将某200ml MgCl2、K2SO4、(NH4)2SO4的混合溶液分成两等份,则每一份溶液的体积为100mL.
取一份加入含a mol氯化钡溶液,刚好使硫酸根沉淀完全,根据Ba2++SO42-=BaSO4↓可知,溶液中的n(SO42-)=amol;而a mol氯化钡向溶液中新引入2amolCl-,故当继续加入含b mol硝酸银溶液,刚好使氯离子沉淀完全时,说明原原溶液中Cl-的物质的量n(Cl-)=(b-2a)mol,故溶液中氯化镁的物质的量为$\frac{b-2a}{2}$mol;
另取一份加入含c mol氢氧化钠的溶液,恰好完全反应,而Mg2+和NH4+均能消耗OH-,根据根据消耗的氢氧化钠的物质的量为cmol,而$\frac{b-2a}{2}$mol镁离子能消耗(b-2a)molOH-,故溶液中的NH4+的物质的量n=c-(b-2a)=(c+2a-b)mol,故溶液中的(NH4)2SO4的物质的量n[(NH4)2SO4]=$\frac{c+2a-b}{2}$mol,而溶液中n(SO42-)=amol,故n(K2SO4)=amol-$\frac{c+2a-b}{2}$mol=$\frac{b-c}{2}$mol,故溶液中钾离子的物质的量为(b-c)mol,而溶液的体积为100mL,故溶液中的钾离子的浓度c=$\frac{(b-c)mol}{0.1L}$=10(b-c)mol/L.
故选D.
点评 本题考查离子反应的有关计算,为高频考点,根据电荷守恒计算钾离子的物质的量是关键,侧重分析与计算能力的考查,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | Na+、Ba2+、Cl-、SO42- | B. | Mg2+、H+、OH-、NO3- | ||
| C. | Mg2+、HSO3-、Na+、Cl- | D. | NH4+、NO3-、K+、SO42- |
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列说法不正确的是( )
| A. | 若用标准状况下4.48L CH4还原NO2生成N2和水蒸气,放出的热量为173.4kJ | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574kJ•mol-1 | |
| C. | 反应①②转移的电子数相同 | |
| D. | 反应②中当4.48L(标准状况)CH4反应完全时转移的电子的物质的量为1.6mol |
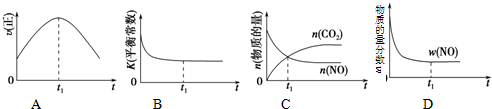
| A. |  | B. |  | C. | 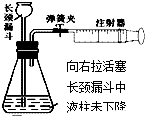 | D. | 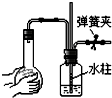 |
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 稳定性:Na2O2>Na2O |