题目内容
9.已知5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 反应中KCl被还原 |
分析 5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素由-1价升高到0,KClO3中Cl元素由+5价降低为0,以此来解答.
解答 解:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素由-1价升高到0,KClO3中Cl元素由+5价降低为0,
A.含元素化合价降低的物质为氧化剂,则KClO3是氧化剂,故A正确;
B.KCl为还原剂,被氧化,KClO3是氧化剂被还原,由反应可知被氧化与被还原的氯元素的质量比为5:1,故B正确;
C.硫酸中各元素的化合价不变,则H2SO4既不是氧化剂又不是还原剂,故C正确;
D.KCl中Cl元素的化合价升高被氧化,故D错误;
故选D.
点评 本题考查氧化还原反应,明确反应中氯元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
19.现有A、B、C、D化合物形成的四种溶液,它们所含有阳离子和阴离子如表:
已知:
①A、B两种溶液都与盐酸反应,都有气泡产生,相同物质的量的A、B两种物质,A含有的阴离子数大于B.
②C溶液呈强碱性.
请回答下列问题:
(1)请写出A、B、C、D四种物质的化学式:AMg(HCO3)2BNa2CO3CBa(OH)2DAgNO3
(2)请写出下列反应的离子方程式:
①A和足量的氢氧化钠溶液的反应:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
②B和足量醋酸溶液的反应:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
③C和少量的硫酸溶液反的应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
④C和少量碳酸氢钠溶液的反应:HCO3-+Ba2++OH-=BaCO3↓+H2O
⑤D和盐酸的反应:Ag++Cl-=AgCl↓.
| 阳离子 | Ba2+、Ag+、Na+、Mg2+ |
| 阴离子 | NO3-、CO32-、OH-、HCO3- |
①A、B两种溶液都与盐酸反应,都有气泡产生,相同物质的量的A、B两种物质,A含有的阴离子数大于B.
②C溶液呈强碱性.
请回答下列问题:
(1)请写出A、B、C、D四种物质的化学式:AMg(HCO3)2BNa2CO3CBa(OH)2DAgNO3
(2)请写出下列反应的离子方程式:
①A和足量的氢氧化钠溶液的反应:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
②B和足量醋酸溶液的反应:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
③C和少量的硫酸溶液反的应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
④C和少量碳酸氢钠溶液的反应:HCO3-+Ba2++OH-=BaCO3↓+H2O
⑤D和盐酸的反应:Ag++Cl-=AgCl↓.
17.研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如表:
①该反应正向反应是吸热反应.(填“放热”或“吸热”)
②能判断该反应达到化学平衡状态的依据是BC.
A.容器压强不变 B.混合气体中c(CO2)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
③当其他条件不变时,若缩小容器的体积,该反应平衡不移动.(选填“正向”、“逆向”或“不”)
(2)工业上合成甲醇可在密闭容器中采用如下反应进行:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
①该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)c(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{3}(H{\;}_{2})}$.
②某实验将1molCO2和3molH2充入一定体积的密闭容器中,在两种不同条件下发生反应(只有一种条件不同).测得CH3OH的物质的量随时间变化如图所示:
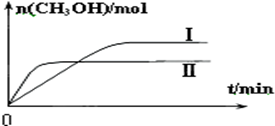
曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(选填“>”、“=”或“<”).
③一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
经测定甲容器经过5min达到平衡,平衡时CO2的转化率为50%,甲容器中该反应在5min内的平均速率υ(H2)=0.15mol•L-1•min-1.
要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.5<n(c)<1.
(1)在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
②能判断该反应达到化学平衡状态的依据是BC.
A.容器压强不变 B.混合气体中c(CO2)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
③当其他条件不变时,若缩小容器的体积,该反应平衡不移动.(选填“正向”、“逆向”或“不”)
(2)工业上合成甲醇可在密闭容器中采用如下反应进行:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
①该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)c(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{3}(H{\;}_{2})}$.
②某实验将1molCO2和3molH2充入一定体积的密闭容器中,在两种不同条件下发生反应(只有一种条件不同).测得CH3OH的物质的量随时间变化如图所示:

曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(选填“>”、“=”或“<”).
③一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.5<n(c)<1.
4.在烧杯中加水和苯(密度为0.88g/cm3)各50mL.将一小粒金属钠(密度为0.97g/cm3)投入烧杯中,观察到的现象可能是( )
| A. | 钠在烧杯底部四处游动 | |
| B. | 钠停留在苯层中无气体放出 | |
| C. | 钠在苯的液面上反应并四处游动 | |
| D. | 钠在苯层与水层的交界处上下跳动,有气泡产生 |
18.在强酸性溶液中可以大量共存的是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Mg2+、H+、OH-、NO3- | ||
| C. | Mg2+、HSO3-、Na+、Cl- | D. | NH4+、NO3-、K+、SO42- |
19.用CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列说法不正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列说法不正确的是( )
| A. | 若用标准状况下4.48L CH4还原NO2生成N2和水蒸气,放出的热量为173.4kJ | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574kJ•mol-1 | |
| C. | 反应①②转移的电子数相同 | |
| D. | 反应②中当4.48L(标准状况)CH4反应完全时转移的电子的物质的量为1.6mol |
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题: