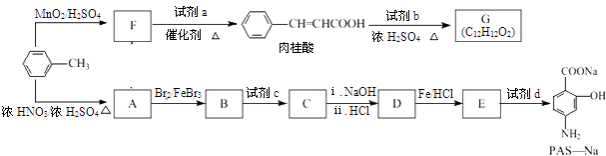
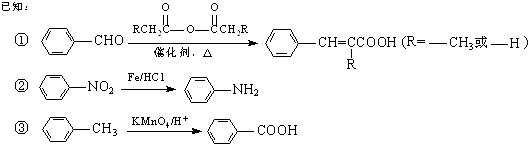
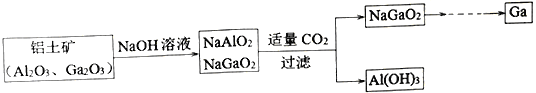
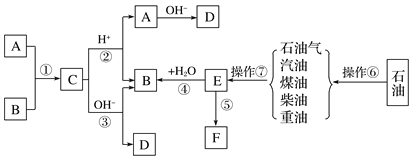
题目内容
【题目】海洋约占地球表面积的71%,具有十分巨大的开发潜力,通过海水的综合利用可获得许多物质供人类使用.
(1)Ⅰ、海水中制得的氯化钠除食用外,还用作工业原料,例如通常以NaCI、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式: .
(2)Ⅱ、工业上以浓缩海水为原料提取溴的部分流程如图1:
已知:Br2常温下呈液态,易挥发,有毒:2Br2+3CO32﹣=5Br﹣+BrO3﹣+3CO2 .
①通过步骤①氯气氧化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液,原因是 .
②反应釜2中发生反应的离子方程式为 .
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 .
(3)Ⅲ、盐卤蒸发冷却后析出卤块的主要成分是MgCI2 , 此外还含有Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如图2(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①用NaClO氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 .
②步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因 .
③NaClO还能除去盐卤中的CO(NH2)2 , 生成盐和能参与大气循环的物质,除去0.1molCO(NH2)2时消耗NaCIOg.
【答案】
(1)NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl
(2)富集溴,提高Br2的浓度;5Br﹣+BrO3﹣+6H+=3Br2+3H2O;温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来
(3)ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;Mg2++2H2O ![]() Mg(OH)2+2H+ , 温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl;22.35
Mg(OH)2+2H+ , 温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl;22.35
【解析】解:Ⅰ、以NaCl、NH3、CO2和水等为原料制取NaHCO3的化学方程式为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,所以答案是:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl;Ⅱ、(1)从①出来的溶液中溴的含量不高,如果直接蒸馏,得到产品成本高,所以经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的为富集溴,提高Br2的浓度,
所以答案是:富集溴,提高Br2的浓度;(2)发生归中反应,离子方程式为:5Br﹣+BrO3﹣+6H+=3Br2+3H2O,所以答案是:5Br﹣+BrO3﹣+6H+=3Br2+3H2O;(3)温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以控制温度在90℃左右进行蒸馏,所以答案是:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来;
Ⅲ、盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+ , 然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;(1)加入次氯酸钠会氧化亚铁离子为三价铁,则次氯酸钠与Fe2+、H2O反应生成Fe(OH)3、Cl﹣和H+ , 反应的离子方程式为:ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;
所以答案是:ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;(2)镁离子水解生成氢氧化镁和氢离子,Mg2++2H2OMg(OH)2+2H+ , 水解反应属于吸热反应,加热温度升高,水解程度增大,通入HCl时,增加了溶液中的c(H+),能使水解平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;所以答案是:Mg2++2H2OMg(OH)2+2H+ , 温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;(3)NaClO还能除去盐卤中的CO(NH2)2 , 生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g,所以答案是:22.35.

 名校课堂系列答案
名校课堂系列答案【题目】在25℃时,密闭容器中X,Y,Z三种气体的起始浓度和平衡浓度如表,下列说法错误的是( )
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.改变温度可以改变该反应的平衡常数