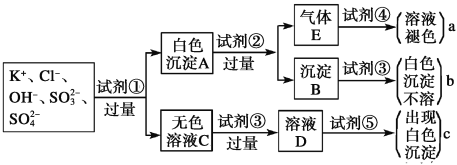
题目内容
【题目】设计实验,对下列物质所含官能团进行检验。
(1)为了证明溴乙烷中存在溴原子,某同学设计如下实验:
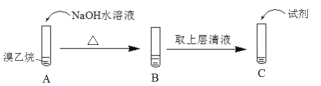
① 将试管C中加入的试剂及相应的实验现象补充完整:_______。
② 溴乙烷在NaOH水溶液中反应的化学方程式是______。
(2)用化学方法检验![]() 含有的官能团。
含有的官能团。
① 完成下表:
官能团 | 检验试剂 | 实验现象 | 化学方程式 |
—OH | FeCl3溶液 | 溶液呈紫色 |
|
—COOH | _______ | 有无色气泡产生 | _______ |
② 不能用溴水检验是否含有碳碳双键,简述理由:_______。
【答案】加入足量稀HNO3调至酸性,再加入AgNO3溶液,有浅黄色沉淀生成 CH3CH2Br + NaOH![]() CH3CH2OH + NaBr NaHCO3溶液
CH3CH2OH + NaBr NaHCO3溶液 ![]() + NaHCO3
+ NaHCO3![]()
![]() + CO2↑+ H2O 该有机物可与溴水发生取代反应而使溴水褪色
+ CO2↑+ H2O 该有机物可与溴水发生取代反应而使溴水褪色
【解析】
(1)溴乙烷与氢氧化钠水溶液在加热的条件下会发生水解反应生成乙醇与溴化钠,上层清液中含溴离子,可以稀硝酸酸化的硝酸银可以检验反应产物中的溴离子,据此分析作答;
(2)![]() 所含官能团为酚羟基、碳碳双键和羧基,①羧酸是有机酸,其酸性强于碳酸,可与碳酸氢钠反应生成二氧化碳,因此碳酸氢钠可用于鉴别分子内羧基的存在,据此填表;
所含官能团为酚羟基、碳碳双键和羧基,①羧酸是有机酸,其酸性强于碳酸,可与碳酸氢钠反应生成二氧化碳,因此碳酸氢钠可用于鉴别分子内羧基的存在,据此填表;
②羟基对苯环产生影响,是连接羟基的苯环上的邻对位较为活跃,可与浓溴水发生取代反应。
(1)因反应后生成溴化钠,为了证明上层溶液中是否含有溴离子,可向溶液C中加入足量稀HNO3调至酸性,再加入AgNO3溶液,若有浅黄色沉淀生成,则根据元素守恒可知,原溴乙烷中存在溴原子,
故答案为:加入足量稀HNO3调至酸性,再加入AgNO3溶液,有浅黄色沉淀生成;
溴乙烷与氢氧化钠水溶液在加热的条件下会发生水解反应生成乙醇与溴化钠,其化学方程式为:CH3CH2Br + NaOH![]() CH3CH2OH + NaBr,
CH3CH2OH + NaBr,
故答案为:CH3CH2Br + NaOH![]() CH3CH2OH + NaBr;
CH3CH2OH + NaBr;
(2)①—COOH可与碳酸氢钠反应生成二氧化碳,产生无色气泡,而酚羟基不能,故可用碳酸氢钠检验该有机物中是否含—COOH,其化学方程式为:![]() + NaHCO3
+ NaHCO3![]()
![]() + CO2↑+ H2O,
+ CO2↑+ H2O,
故答案为:![]() + NaHCO3
+ NaHCO3![]()
![]() + CO2↑+ H2O。
+ CO2↑+ H2O。

【题目】实验小组探究甲烷与氯气的取代反应,装置、现象如下:
现象 |
ⅰ.光照后,产生白雾,混合气体颜色变浅 ⅱ.试管内液面上升至试管的2/3;试管壁和液面上出现少量油状液滴 |
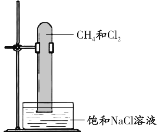
下列说法不正确的是
A. 饱和食盐水可以减少氯气的溶解
B. 油状液滴的主要成分是一氯甲烷
C. 产生白雾以及试管内液面上升证明有氯化氢生成
D. 为了探究反应条件,可用黑色纸套套住装满甲烷和氯气的试管,一段时间后进行观察