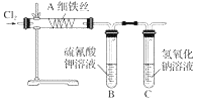
题目内容
【题目】氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是( )
A.NaH在水中显酸性B.NaH中氢离子电子排布与氦原子相同
C.NaH中氢离子半径比锂离子大D.NaH中氢离子可以被还原成氢气
【答案】BC
【解析】
A.氢化钠和水反应生成氢气,根据原子守恒判断另一种物质,由生成物的酸碱性判断;B.先判断氢离子的电子数,再把其电子层排布与氦原子的比较判断;C.根据电子层结构相同的离子半径与核电荷数的关系判断;D.根据氢化钠和水反应时化合价的变化判断;
A.氢化钠和水反应生成氢气和氢氧化钠,其反应方程式为NaH+H2O=H2![]() +NaOH,生成物中有氢氧化钠,所以显碱性,故A错误。
+NaOH,生成物中有氢氧化钠,所以显碱性,故A错误。
B.NaH中H元素是-1价,其核外电子数为2所,以其电子层排布与氦原子的相同,故B正确。
C.负一价氢离子和锂离子的电子层结构相同,电子层结构相同的离子半径与核电荷数成反比,所以氢离子半径大于锂离子半径,故C正确;
D.由反应NaH+H2O=H2![]() +NaOH可知,氢化钠氢离子失电子被氧化生成氢气,故D错误;
+NaOH可知,氢化钠氢离子失电子被氧化生成氢气,故D错误;
答案:BC。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目