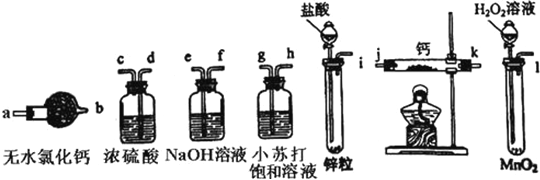
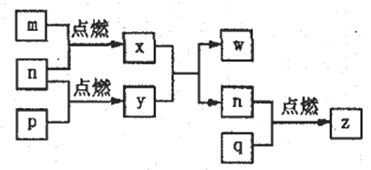
题目内容
【题目】铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。

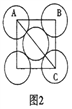
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为acm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含a、M、NA的代数式来表示)。
【答案】 1s22s22p63s23p1 小于 离子晶体 正四面体 sp3 面心立方 ![]()
【解析】试题分析:本题考查物质结构与性质,主要考查核外电子排布式的书写,第一电离能的比较,空间构型和杂化方式的判断,晶体类型的判断,金属晶体的堆积方式,晶胞的计算。
(1)Al的原子序数为13,基态Al原子核外有13个电子,根据构造原理,基态铝原子的核外电子排布式为1s22s22p63s23p1。
(2)Al的价电子排布式为3s23p1,Mg的价电子排布式为3s2,Mg的3s处于全充满,较稳定;第一电离能:Al小于Mg。
(3)工业上用电解Al2O3方法制取金属Al,说明熔融Al2O3能导电,Al2O3属于离子晶体。
(4)AlH4-中中心原子Al的孤电子对数为![]() (3+1-4
(3+1-4![]() 1)=0,Al的价层电子对数为0+4=4,AlH4-的VSEPR模型为正四面体型,由于Al上没有孤电子对,AlH4-的立体构型为正四面体型。中心原子Al原子采取sp3杂化。
1)=0,Al的价层电子对数为0+4=4,AlH4-的VSEPR模型为正四面体型,由于Al上没有孤电子对,AlH4-的立体构型为正四面体型。中心原子Al原子采取sp3杂化。
(5)①根据铝的晶胞结构知,晶体Al中原子的堆积方式为面心立方。
②铝原子半径为acm,根据原子间相对位置关系的平面图,晶胞的边长为![]() =2
=2![]() acm,晶胞的体积为(2
acm,晶胞的体积为(2![]() acm)3=16
acm)3=16![]() a3cm3,用“均摊法”,1个晶胞中含Al:8
a3cm3,用“均摊法”,1个晶胞中含Al:8![]() +6
+6![]() =4,1mol晶体的体积为
=4,1mol晶体的体积为![]() cm3NA=4
cm3NA=4![]() a3NAcm3,1mol晶体的质量为Mg,晶体铝的密度ρ=Mg
a3NAcm3,1mol晶体的质量为Mg,晶体铝的密度ρ=Mg![]() (4
(4![]() a3NAcm3)=
a3NAcm3)=![]() g/cm3。
g/cm3。