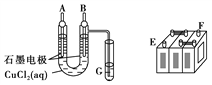
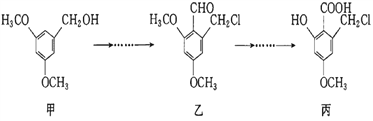
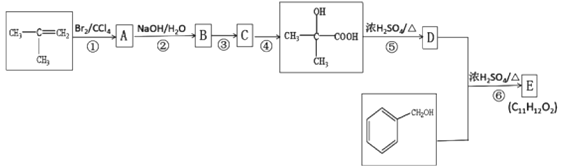
题目内容
【题目】下列不能减慢锌与稀盐酸的反应速率的措施是
A. 降低温度B. 加入氯化钠溶液
C. 加入少量CH3COONa固体D. 增大锌的用量
【答案】D
【解析】
A. 降低温度,反应速率减慢,故此项不选;
B. 加入氯化钠溶液,溶液被稀释,反应物浓度降低,速率减慢,故此项不选;
C. 加入少量CH3COONa固体,与盐酸反应后生成醋酸,降低了氢离子浓度,反应速率降低,故此项不选;
D. 增大锌的用量,锌为固体,对反应速率没有影响,故此项符合题意;
故选D。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
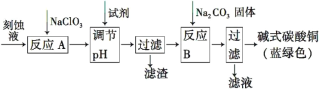
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。