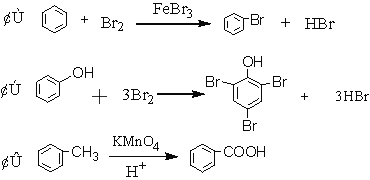
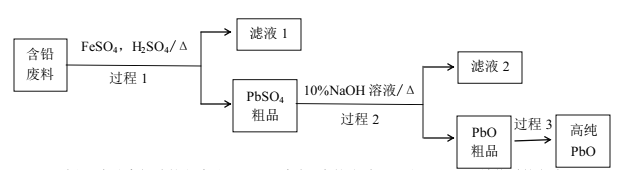
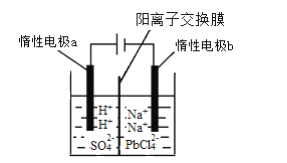
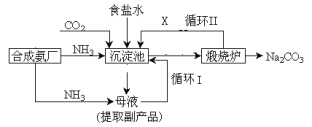
题目内容
【题目】A.①CaCO3(s)=CaO(s)+CO2(g) ΔH=-177.7 kJ/mol
②0.5H2SO4(l)+NaOH(l)=0.5Na2SO4(l)+H2O(l) ΔH=-57.3 kJ/mol
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
④CO(g)+![]() O2(g)=CO2(g) ΔH=-283 kJ/mol
O2(g)=CO2(g) ΔH=-283 kJ/mol
⑤HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ/mol
(1)上述热化学方程式中,不正确的有____________________。(填序号,以下同)
(2)上述反应中,表示燃烧热的热化学方程式是____________________________;上述反应中,表示中和热的热化学方程式是________________________。
B.已知热化学方程式:C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.41 kJ/mol;C(s,石墨)+O2(g)=CO2(g) ΔH=-393.51 kJ/mol
(3)则金刚石转化为石墨的热化学方程式为_____,由热化学方程式看来更稳定的碳的同素异形体是_____。
【答案】①② ③④ ⑤ C(s,金刚石))=C(s,石墨) ΔH=-1.9 kJ/mol 石墨
【解析】
判断热化学方程式书写是否正确,首先要保证符合基本的守恒关系,其次要正确标注各物质的聚集状态,最后要注意ΔH的数值要与化学计量系数对应,符号和单位要正确书写,至于温度和压强一般的反应不需要特殊标注。描述燃烧热的热化学方程式,务必要保证可燃物的化学计量系数为1,并且生成的是指定产物,如可燃物中的C元素转化为CO2(g),H元素转化为H2O(l)等。
A.(1)碳酸钙分解生成CO2和CaO的反应是吸热反应,因此热化学方程式①中的焓变应是正值,故①错误;硫酸与氢氧化钠的中和反应是在水溶液中进行的,因此H2SO4,NaOH和Na2SO4的聚集状态应标注为aq而非l,故②错误;
(2)热化学方程式③,④中可燃物C,CO的化学计量系数均为1,并且C元素最终都只生成了CO2(g),因此③④分别表示的是C,CO的燃烧热的热化学方程式;
(3)硝酸与氢氧化钠溶液反应只生成水,并且热化学方程式⑤中,水的化学计量系数为1,所以⑤可以表示中和热的热化学方程式;
B.由题可知1mol金刚石转化为1mol石墨的反应![]() ,所以相应的热化学方程式为:C(s,金刚石)=C(s,石墨)
,所以相应的热化学方程式为:C(s,金刚石)=C(s,石墨) ![]() ;该反应是放热反应,说明1mol石墨中存储的化学能更少,所以相同条件下,石墨更为稳定。
;该反应是放热反应,说明1mol石墨中存储的化学能更少,所以相同条件下,石墨更为稳定。