题目内容
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
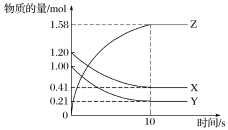
(1)从反应开始到10 s时,用Y表示的反应速率为____________________。
(2)该反应的化学方程式为_______________________。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:
甲:v(X)=0.3 mol·L-1·s-1;
乙:v(Y)=0.12 mol·L-1·s-1
丙:v(Z)=9.6 mol·L-1·min-1;
则甲、乙、丙三个容器中反应速率由慢到快的顺序为__________________。
【答案】
(1)0.0395mol·L-1·s-1;
(2) X+Y![]() 2Z;
2Z;
(3) 丙<乙<甲
【解析】
试题分析:(1)从反应开始到10s时,Y的物质的量变化为:1.00mol-0.21mol=0.79mol,则该段时间内用Y表示的反应速率为:v(Y)=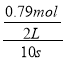 =0.0395 molL-1s-1;故答案为:0.0395 molL-1s-1;
=0.0395 molL-1s-1;故答案为:0.0395 molL-1s-1;
(2)由图象可以看出,反应中X、Y的物质的量减少,应该为反应物,Z的物质的量增多,应为生成物,当反应进行到10s时,△n(X)=0.79mol、△n(Y)=0.79mol、△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:X(g)+Y(g) ![]() 2Z(g),故答案为:X(g)+Y(g)
2Z(g),故答案为:X(g)+Y(g) ![]() 2Z(g);
2Z(g);
(3)均转化为X的速率,甲:v(X)=0.3 mol·L-1·s-1;乙:v(X)=v(Y)=0.12 mol·L-1·s-1,丙:v(X)=![]() v(Z)=4.8 mol·L-1·min-1=0.08 mol·L-1·s-1,则甲、乙、丙三个容器中反应速率由慢到快的顺序为丙<乙<甲,故答案为:丙<乙<甲。
v(Z)=4.8 mol·L-1·min-1=0.08 mol·L-1·s-1,则甲、乙、丙三个容器中反应速率由慢到快的顺序为丙<乙<甲,故答案为:丙<乙<甲。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案