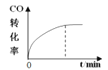
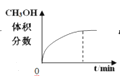
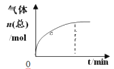
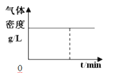
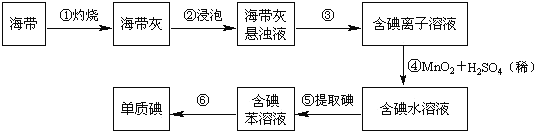
��Ŀ����
����Ŀ�����������ϸ��ˮƽ������Ч��������״�����ĸ�Ⱦ���������(H)��������һ���������Ƶã�����һ�ֺϳɷ������£�
��֪��
�ص��������⣺
(1)A�к��еĹ���������Ϊ_____________��
(2)B�ķ���ʽΪ_____________��
(3)̼ԭ��������4����ͬ��ԭ�ӻ����ʱ����̼ԭ�ӳ�Ϊ����̼ԭ�ӣ�H����_________������̼ԭ�ӡ�
(4)F��H�ķ�Ӧ����Ϊ_____________��
(5)C��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ___________________________________________��
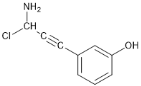
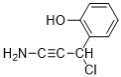
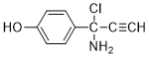
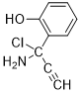
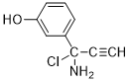
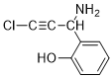
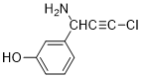
(6)E��������Ӧ��IJ���M�ķ���ʽΪC9H8NOCl����������������M��__________�֡�
����FeCl3��Һ������ɫ��Ӧ �ڳ������ⲻ��������״�ṹ
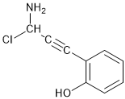
�۱�����ֻ��2��ȡ���� �ܺ��У�NH2��![]()
���к˴Ź���������5��壬�ҷ����֮��Ϊ1��2��2��1��2��M�Ľṹ��ʽΪ___________��(��д2��)
���𰸡���������ԭ�� C6H6NCl 1 ȡ����Ӧ 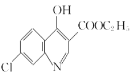 +2NaOH
+2NaOH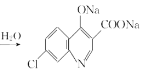 +CH3CH2OH+H2O 12
+CH3CH2OH+H2O 12 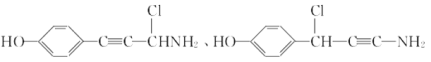
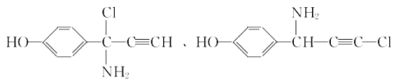
��������
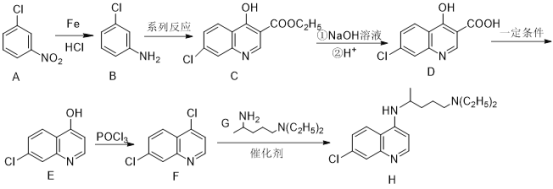
��ͼ��֪��������A��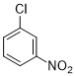 ��������ԭ����������ԭ�ɰ������õ�B��
��������ԭ����������ԭ�ɰ������õ�B��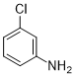 ����B������Ӧ�õ�C��
����B������Ӧ�õ�C��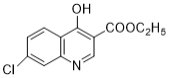 ����C����NaOH������ˮ����H+����ऻ��ϵ����Ʊ���ǻ��õ�D��
����C����NaOH������ˮ����H+����ऻ��ϵ����Ʊ���ǻ��õ�D��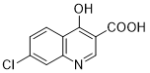 ����D��һ����������ȥ�Ȼ����õ�E��
����D��һ����������ȥ�Ȼ����õ�E��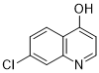 ����E���������������·���ȡ�������ǻ�ȡ��Ϊ�ȣ��õ�F��
����E���������������·���ȡ�������ǻ�ȡ��Ϊ�ȣ��õ�F�� ����F�е�Cl��
����F�е�Cl��![]() �еİ����ⷢ��ȡ���õ����ղ�����ୡ�
�еİ����ⷢ��ȡ���õ����ղ�����ୡ�
��1��������AΪ ������������������ԭ�ӣ�
������������������ԭ�ӣ�
��2��������BΪ ������ʽ��C6H6NCl��
������ʽ��C6H6NCl��
��3��������H������ֻ̼��1��������*����ǣ���ͼ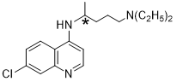 ��
��
��4���ɷ�����֪��F��H�ķ�ӦΪȡ����Ӧ��
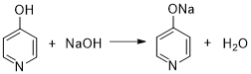
��5�����ݷ�������֪��C��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ��
 +2NaOH
+2NaOH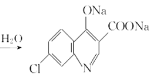 +CH3CH2OH+H2O��
+CH3CH2OH+H2O��
��6���������⣬������M���з��ǻ���������̼̼�������������ұ�����ֻ��2��ȡ������ͬ���칹���У�![]() ��
�� ��
�� ��
��![]() ��
�� ��
�� ��
�� ��
�� ��
�� ��
��![]() ��
�� ��
�� ����12�֣�
����12�֣�
���У����к˴Ź���������5��壬�ҷ����֮��Ϊ1��2��2��1��2�������֣�![]() ��
��![]() ��
�� ��
��![]() ��
��

 ����ѧҵ���Ե�����ϵ�д�
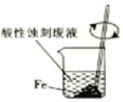
����ѧҵ���Ե�����ϵ�д�����Ŀ�����������һ�ָ�Ч��ܵ����ͷ�����ɫ����������Ҫ������ˮ������ʵ��С���Ʊ�������أ�K2FeO4����̽�������ʡ�
���ϣ�K2FeO4Ϊ��ɫ���壬����KOH��Һ������ǿ�����ԣ������Ի�������Һ�п��ٲ���O2���ڼ�����Һ�н��ȶ���
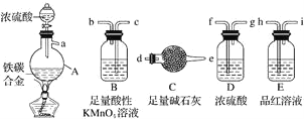
(1)�Ʊ�K2FeO4���г�װ���ԣ�
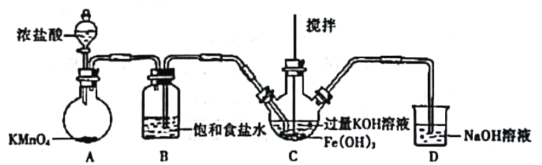
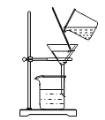
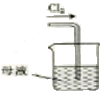
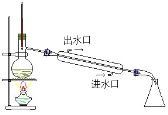
����ͼ��ʾ��AΪ��������װ�á�װ��A��B��C��D�д��ڴ������______________������ţ���
��C�еõ���ɫ�������Һ��C��ͨ������������Ӧ�����ɸ�����أ�K2FeO4���Ļ�ѧ����ʽΪ_______������Cl2�������������KOH��Ӧ��
(2)̽��K2FeO4������
��ȡC����ɫ��Һ������ϡ���ᣬ��������ɫ���壬����Һa�������������к���Cl2��Ϊ֤���Ƿ�K2FeO4��������Cl��������Cl2��������·�����
����I | ȡ������Һa���μ�KSCN��Һ����������Һ�ʺ�ɫ�� |
����II | ��KOH��Һ���ϴ��C�����ù��壬����KOH��Һ��K2FeO4�ܳ����õ���ɫ��Һb��ȡ����b���μ����ᣬ��Cl2������ |
i.�ɷ���I����Һ����֪��Һa�к���__________���ӣ��������ӵĴ��ڲ����ж�һ����K2FeO4��������Cl2����ΪK2FeO4����������Һ�в��ȶ�����д��K2FeO4��������Һ�з�����Ӧ�����ӷ���ʽ___________________________________��
ii���������֤��K2FeO4��������Cl������KOH��Һϴ�ӵ�Ŀ����_______________��
�ڸ���K2FeO4���Ʊ�ʵ��ó���������Cl2_____FeO42�� �����������������������ʵ�������Cl2��FeO42����������ǿ����ϵǡ���෴��ԭ����_______________��
(3)�����Ʊ�װ��C�м���Fe(OH)3������Ϊ14.0g����ַ�Ӧ���ˡ�ϴ�ӡ������K2FeO4����19.3g����K2FeO4�IJ���Ϊ______________��
����Ŀ��25 ��ʱ���������ʵĵ��볣�����±���ʾ��
��ѧʽ | CH3COOH | H2C2O4 | H2S |
���볣�� | 1.8��10��5 | Ka1��5.4��10��2 Ka2��5.4��10��5 | Ka1��1.0��10��7 Ka2��7.1��10��15 |
��ش��������⣺
��1������CH3COOH��H2C2O4��HC2O4-��H2S��HS- ����������,����������������________��
��2��CH3COOH��H2C2O4��H2S��������ǿ������˳��Ϊ_____________________��
��3��NaHS��Һ��NaHC2O4��Һ��Ӧ�����ӷ���ʽΪ_______________��
��4��0.1 mol��L��1H2S��Һ��c(H+)=________ mol��L��1��