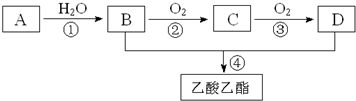
题目内容
3.下列有关化学用语的表示方法中正确的是( )| A. | H2O2的电子式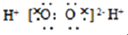 | |
| B. | NH4I的电子式 | |
| C. | 原子核内有8个中子的碳原子:${\;}_{8}^{14}$C | |
| D. | CO2分子的结构式:O=C=O |
分析 A、双氧水为共价化合物,其分子中存在两个氧氢键和1个氧氧键;
B、没有标出碘离子的最外层电子;
C、质量数=质子数+中子数;
D、二氧化碳是直线形结构,每个氧原子和碳原子形成碳氧双键.
解答 解:A、H2O2为共价化合物,其电子式为: ,故A错误;
,故A错误;
B、没有标出碘离子的最外层电子,NH4I的电子式: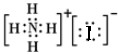 ,故B错误;
,故B错误;
C、质量数=质子数+中子数,则8个中子的碳原子的核素符号:${\;}_{6}^{14}C$,故C错误;
D、二氧化碳是直线形结构,每个氧原子和碳原子形成碳氧双键,其结构式为:O=C=O,故D正确,
故选D.
点评 本题考查了电子式的书写,题目难度中等,充分考查了学生对书写知识的掌握情况,注意掌握离子化合物与共价化合物电子式的书写原则,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
13.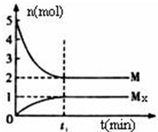 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A. | 平衡时混合气体的平均摩尔质量是33.3g/mol | |
| B. | t1时刻,保持温度不变,再充入5molM,重新达到平衡时,c(Mx)/c(M)将减小 | |
| C. | 该反应的化学方程式是2HF?(HF)2 | |
| D. | M的沸点比同主族下一周期元素的气态氢化物沸点低 |
14.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图.下列有关说法正确的是( )
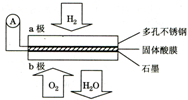

| A. | a极为负极,工作过程中a极附近酸性增强 | |
| B. | 电池总反应可表示为:2H2+O2=2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1mol电子,消耗标准状况下2.24L H2 |
11.下列说法正确的是( )
| A. | 油脂是植物油和动物脂肪的统称,分子的不饱和程度越大,熔点越低 | |
| B. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应,是两性氧化物 | |
| C. | 石油经裂化得到的汽油可用来萃取溴水中的Br2 | |
| D. | 麻黄碱(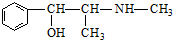 )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 |
18.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1Ca(NO3)2溶液中:Na+、N${{H}_{4}}^{+}$、C${{O}_{3}}^{2-}$、CH3COO- | |
| B. | 能使甲基橙变红的溶液中:K+、Na+、N${{O}_{3}}^{-}$、Cl- | |
| C. | 3%H2O2溶液中:Fe2+、H+、S${{O}_{4}}^{2-}$、Cl- | |
| D. | 0.1 mol•L-1KSCN溶液中:Fe3+、N${{H}_{4}}^{+}$、Br-、S${{O}_{4}}^{2-}$ |
8.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法正确的是( )
| A. | X的氢化物溶于水显酸性且稳定性弱于HF | |
| B. | Y的氧化物是离子化合物,Y的氢氧化物碱性比氢氧化钠弱 | |
| C. | Z的氢化物的水溶液在空气中存放不易变质 | |
| D. | X和Z的最高价氧化物对应的水化物都是弱酸 |
15.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| B. | 常温下,1L 0.1mol/LNa2S溶液中,含有S2-数为0.1NA | |
| C. | 7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA | |
| D. | 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3 mol Cl2转移的电子数为6NA |
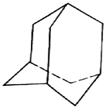 有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示: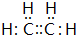 ;
;