题目内容
2.下列有关σ键的说法错误的是( )| A. | 如果电子云图象是由两个s电子重叠形成的,即形成s-sσ键 | |
| B. | s电子与p电子形成s-pσ键 | |
| C. | p电子和p电子不能形成σ键 | |
| D. | HCl分子里含有一个s-pσ键 |
分析 由两个相同或不相同的原子轨道沿轨道对称轴方向相互重叠而形成的共价键,叫做σ键σ键,有s-s σ键、s-p σ键.
解答 解:A.如果电子云图象是由两个s电子头对头重叠形成的,即形成s-sσ键,故A正确;
B.s电子与p电子头对头能形成s-p σ键,如氯化氢分子中含有s-p σ键,故B正确;
C.p电子与p电子头对头能形成σ键,肩并肩能形成π键,故C错误;
D.氯化氢分子中氢原子中的S电子与氯原子中的P电子头对头形成s-p σ键,故D正确;
故选C.
点评 本题考查了σ键σ键,明确化学键的形成是解本题关键,难度不大.

练习册系列答案
相关题目
13.设NA为阿伏伽德罗常数的值,下列说法错误的是( )
| A. | 0.1molMg2+含有NA个电子 | |
| B. | 1mol•L-1的NaCl溶液中含有NA个Na+ | |
| C. | 2molCu与足量S加热充分反应,转移2NA个电子 | |
| D. | 4gCH4与Cl2在光照条件下反应全部转化为CCl4时,断裂NA个C-H键 |
17.下列说法正确的是( )
| A. | 最外层有2个电子的元素都是金属元素 | |
| B. | 不管哪一个电子层作为最外层,其电子数都不能超过8个 | |
| C. | 在原子核外的电子层中,电子层大的能量低,电子层小的能量高 | |
| D. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
7.汽车尾气的转化反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g),若反应在容积为0.5L的密闭容器中进行,由该反应相关图象作出的判断正确的是( )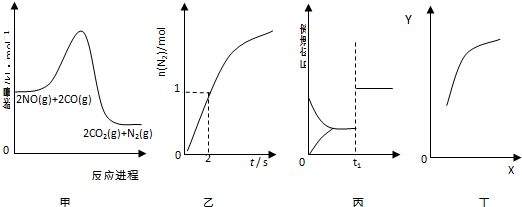

| A. | 由图象甲可知,该反应正反应为放热反应 | |
| B. | 由图象乙可知,0~2s内平均速率V(CO)=1mol•L-1•s-1 | |
| C. | 由图象丙可知,t1时改变的条件可能为增大压强 | |
| D. | 由图象丁中,若X为c(CO),则纵坐标Y可能为NO的转化率 |
11.下列各组物质气化或熔化时,所克服的微粒间的作用力,属同种类型的是( )
| A. | 氯化钠和铁的熔化 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 碘和干冰的升华 | D. | 食盐和冰的熔化 |
 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.