��Ŀ����
����Ŀ����1����Cu ��CO2 ��H2SO3��H2O��Һ̬HCl ��H2SO4��Ba��OH��2 ��NaCl ������ ��NaOH��Һ
�������������ڵ���ʵ���______________�����ڷǵ���ʵ���________���ܵ������_________�� ������ţ�������ȫ�����÷֣�
��2����16g��������ԭ��������ͬ�İ�����_________________g��
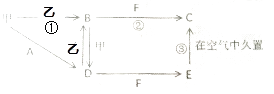
��3����֪ʵ������ȡ�����ķ�Ӧԭ��ΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________
�ڵ�2 mol MnO2�μӷ�Ӧʱת�Ƶ���______mol
�۵�ת��1 mol����ʱ�����ɱ�״���µ�Cl2______L
��Ũ�����ڷ�Ӧ����ʾ������������______������ĸ��
a.��ԭ�� b.���� c.������ d. �ӷ���
���𰸡� �ۢܢݢޢߢ� �ڢ� �٢� 4.25 1:2 4 11.2 ab
��������(1)��CuΪ�������ʣ����������ƶ��ĵ��ӣ��ܵ��磬�Ȳ��ǵ����Ҳ���Ƿǵ���ʣ���CO2���ܵ��磬���������ܵ��룬�Ƿǵ���ʣ���H2SO3���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ���H2O���ܵ��磬�ǵ���ʣ���Һ̬HCl ���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ���H2SO4���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ���Ba��OH��2���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ���NaCl���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ������Dz��ܵ��磬�Ƿǵ���ʣ���NaOH��Һ�ǻ����ܵ��磬�Ȳ��ǵ����Ҳ���Ƿǵ���ʣ������ڵ���ʵ��Ǣۢܢݢޢߢࣻ���ڷǵ���ʵ��Ǣڢ�ܵ�����Ǣ٢⣻��Ϊ���ۢܢݢޢߢ����ڢ����٢���
��2��n��O2��=![]() =
=![]() =0.5mol,n��O��=0.5mol��2=1mol �� n��NH3��=
=0.5mol,n��O��=0.5mol��2=1mol �� n��NH3��=![]() =0.25mol����m��NH3��=0.25mol��17g/mol=4.25g������4.25
=0.25mol����m��NH3��=0.25mol��17g/mol=4.25g������4.25
��3����MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O�У�MnԪ�صĻ��ϼ۽��ͣ���MnO2Ϊ��������ClԪ�صĻ��ϼ����ߣ���������HClΪ��ԭ��������4molHCl��ֻ��2mol������ �����Ը÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ��1:2 ,��Ϊ��1:2
MnCl2+Cl2��+2H2O�У�MnԪ�صĻ��ϼ۽��ͣ���MnO2Ϊ��������ClԪ�صĻ��ϼ����ߣ���������HClΪ��ԭ��������4molHCl��ֻ��2mol������ �����Ը÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ��1:2 ,��Ϊ��1:2
��MnԪ�صĻ��ϼ���+4�۽�Ϊ+2�ۣ���1molMnO2�μӷ�Ӧʱ��ת�Ƶ��ӵ����ʵ���=1mol��(4-2)=2mol����2 mol MnO2�μӷ�Ӧʱת�Ƶ��������ʵ���=2mol��2=4mol ��Ϊ��4
��ÿת��2mol�������ɱ�״����Cl2�����ʵ���Ϊ1mol����ת��1mol�������ɱ�״����Cl2�����ʵ���Ϊ0.5mol�����Ϊ��11.2L,��Ϊ��11.2L,
�ܸ÷�Ӧ�У�Ũ�����е���Ԫ�ز���ʧȥ��������ԭ�������ֻ��ϼ۲��䣬���ᣬ����Ũ�����ڷ�Ӧ����ʾ�����������ǻ�ԭ�Ժ����ԣ���Ϊ��ab