题目内容
【题目】酯化反应是酸与醇发生反应生成酯和水的反应。下列反应属于酯化反应的是( )
A.CH3COOH+NaOH→CH3COONa+H2O
B.CH2==CHCOOCH3+H2![]() CH3CH2COOCH3
CH3CH2COOCH3
C.CH3COOCH2CH3+H2O![]() CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
D.2CH3COOH+HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3+2H2O
CH3COOCH2CH2OOCCH3+2H2O
【答案】D
【解析】
A.CH3COOH+NaOH→CH3COONa+H2O属于中和反应,故不选A;
B.CH2==CHCOOCH3+H2![]() CH3CH2COOCH3属于加成反应,故不选B;
CH3CH2COOCH3属于加成反应,故不选B;
C.CH3COOCH2CH3+H2O![]() CH3COOH+CH3CH2OH属于酯的水解反应,故不选C;
CH3COOH+CH3CH2OH属于酯的水解反应,故不选C;
D.2CH3COOH+HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3+2H2O是乙酸和乙二醇生成酯的反应,属于酯化反应,故选D;
CH3COOCH2CH2OOCCH3+2H2O是乙酸和乙二醇生成酯的反应,属于酯化反应,故选D;
故答案选D。

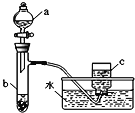
【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?__________(“是”或“否”),理由是____________________________________________________。
(3)对比试管a、b、c的实验现象,可知pH增大![]() _____(选填“增大”,“减小”,“不变”);
_____(选填“增大”,“减小”,“不变”);
(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-__________CrO42-(填“大于”,“小于”,“不确定”);写出此过程中氧化还原反应的离子方程式_________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________。