题目内容
【题目】高纯氧化铁是现代电子工业的重要材料。
(1)以赤铁矿(主要成分:Fe2O3,杂质为FeO、Al2O3、SiO2、CuO等)为原料可制备高纯氧化铁,制备流程如下:
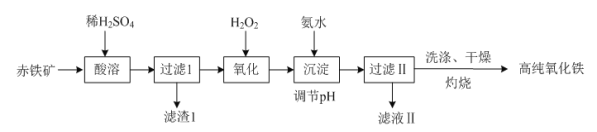
①“酸溶”时Al2O3发生反应的化学方程式为_________________________________。
②“氧化”时发生反应的离子方程式为____________________________。
③“灼烧”时发生反应的化学方程式为______________________________。
④滤渣Ⅰ的主要成分与NaOH溶液反应的离子方程式为_______________________________。
(2)FeCO3在空气中高温灼烧也可以制备高纯氧化铁,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目:_________。
【答案】Al2O3+3H2SO4===Al2(SO4)3+3H2O 2Fe2++H2O2+2H+===2Fe3++2H2O 2Fe(OH)3 ![]() Fe2O3+3H2O SiO2+2OH-===SiO32—+H2O
Fe2O3+3H2O SiO2+2OH-===SiO32—+H2O 
【解析】
由流程图可知,向赤铁矿中加入稀硫酸酸溶时,氧化铁、氧化亚铁、氧化铝和氧化铜溶于稀硫酸,二氧化硅不溶,则过滤后得到含有铁离子、铝离子、铜离子和亚铁离子的滤液和滤渣二氧化硅;向滤液中加入双氧水,双氧水将亚铁离子氧化为铁离子,氧化后再加入氨水调节溶液pH,使铁离子完全转为氢氧化铁沉淀,则过滤后得到含有铝离子、铜离子的滤液和滤渣氢氧化铁;氢氧化铁沉淀沉淀经洗涤、干燥、灼烧得到高纯氧化铁。
(1)①“酸溶”时,Al2O3与稀硫酸反应生成硫酸铝和水,反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O,故答案为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
②“氧化”时,双氧水将亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③“灼烧”时,氢氧化铁受热分解生成氧化铁和水,反应的化学方程式为2Fe(OH)3 ![]() Fe2O3+3H2O,故答案为:2Fe(OH)3
Fe2O3+3H2O,故答案为:2Fe(OH)3 ![]() Fe2O3+3H2O;
Fe2O3+3H2O;
④滤渣Ⅰ的主要成分是二氧化硅,二氧化硅与NaOH溶液反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32—+H2O,故答案为:SiO2+2OH-=SiO32—+H2O;
(2)FeCO3在空气中高温灼烧生成氧化铁时,铁元素化合价升高被氧化说明FeCO3做还原剂,空气中氧气做氧化剂,4mol FeCO3反应,转移的电子数目为4mol,则电子转移的方向和数目为 ,故答案为:
,故答案为: 。
。