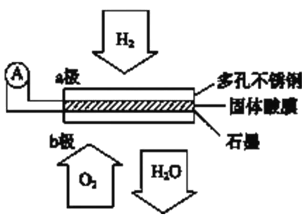
��Ŀ����
����Ŀ����ͼΪһ��������ͼ����С����ͼ���Ϸֱ�д��H2��CO2��Na2O��NaCl��FeCl3�������ʣ�ͼ���������������ʾ��ɹ���Ϊһ�࣬�ཻ����A��B��C��DΪ����Ӧ�ķ������ݴ��š���ش��������⣺

(1)�뽫�������ݴ���������Ӧ�������ڣ�
��__________���������ʶ����ǵ����
��__________���������ʶ����ƵĻ�����
��__________���������ʶ���������
��__________���������ʶ�����
(2)�ýྻ���ձ�ȡ��������ˮ���þƾ��Ƽ��������ڣ����ձ�����μ���1 mol/L����ͼ��ij������M��ˮ��Һ��������п��Ƶ�һ�ֺ��ɫ���塣
������M�Ļ�ѧʽΪ______________��
��֤���к��ɫ�������ɵ�ʵ��ԭ����_____________��
���𰸡�A C B D FeCl3 ��һ���������ձ��е�Һ�壬���ܲ���һ��������ͨ·��֤��������Fe(OH)3����
��������
(1)���ݵ��������ˮ��Һ�л�����״̬���ܵ���Ļ�����ƵĻ������Ǻ�����Ԫ�صĻ����������������������һ��Ԫ����ɵĻ���������ɽ��������Ӻ����������ɵĻ����������
(2)�����������������Ʊ������ͽ�������ʷ����жϡ�
(1)���������ˮ��Һ�л�����״̬�µ���Ļ����Na2O�����ӻ����������״̬��������Na+��O2-�����ڵ���ʣ�NaCl��FeCl3�����Σ���ˮ��Һ������״̬�»������������ƶ������Ӷ����磬���ڵ���ʣ�H2�ǵ��ʲ����ڵ���ʣ�������̼����CO2���ӹ��ɣ���ˮ����ˮ��Ӧ����H2CO3��H2CO3������������ƶ������Ӷ����磬������״̬����Ȼ��CO2���Ӵ��ڣ����ܵ�����������ƶ������ӣ����ڷǵ���ʣ���AΪH2��CO2���Ի�Ϊһ��������Dz��ǵ���ʣ�
Na2O��NaCl�ж�����NaԪ�أ����Ǻ�����Ԫ�صĻ��������C��Ϊһ����������ƵĻ����
CO2��Na2O����������Ԫ�أ�����һ��Ԫ��������������������һ��Ԫ����ɵĻ����Ϊ�����B��Ϊһ��������Ƕ��������
NaCl�������Na+��Cl-��FeCl3�������Fe3+��Cl-���������ʶ��ǽ��������Ӻ���������ӹ��ɵĻ���������Σ�����D��Ϊһ��������Ƕ��߶����Σ�
(2)�������������Ʊ��������ͷ�ˮ�м��뱥���Ȼ�����Һ�������ʺ��ɫ�õ�������������Ϊ���ɫ�����ж�MΪFeCl3��������ж����ЧӦ������Ϊ����һ���������ձ��е�Һ�壬���ܲ���һ��������ͨ·��֤��������Fe(OH)3���壬�������˶����ЧӦ��