题目内容
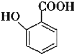
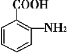
【题目】(1)铜、硝酸银溶液和银组成的原电池装置中,当导线中有0.02mol电子通过时,理论上银片的质量变化了多少?
(2)将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) =xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5。求:(1)x的值和反应开始前放入容器中A、B的物质的量。
【答案】(1)2.16g (2)2,3mol
【解析】
试题分析:(1)Cu、Ag和硝酸银溶液构成原电池,Cu易失电子作负极、发生反应Cu-2e-=Cu2+,Ag作正极、发生反应Ag++e-=Ag,所以银片质量增加,当导线中有0.02mol电子通过时,理论上银片的质量m(Ag)=108g/mol×0.02mol=2.16g。
故答案为:2.16g;
(2)将等物质的量的A、B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L=1mol,则:
3A(g)+B(g)![]() xC(g)+2D(g)
xC(g)+2D(g)
起始量(mol): n n 0 0
变化量(mol): 1.5 0.5 0.5x 1
5min时(mol):n-1.5 n-0.5 0.5x 1
由于5min时c(A):c(B)=3:5,则(n-1.5):(n-0.5)=3:5,解得n=3,
由题意可知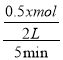 =0.1mol/(Lmin),则x=2。
=0.1mol/(Lmin),则x=2。
故答案为:2;3mol。

练习册系列答案
相关题目