题目内容
【题目】研究氮及其化合物的性质具有极为重要的意义。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________________________
(2)在含Cu+离子的酶的活化中,亚硝酸根 (NO2-)离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式 。
(3)将38.4 g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
① NO2的体积为____________L。
②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为____________molL-1。
【答案】(1)3NO2+H2O===2HNO3+NO
(2)Cu++NO2-+2H+=Cu2++NO↑+H2O
(3) 3.36 11.3
【解析】
试题分析:(1) NO2和水反应转化为HNO3的化学方程式:3NO2+H2O===2HNO3+NO
(2) Cu+和亚硝酸根离子在酸性水溶液中反应,亚硝酸根 (NO2-)离子可转化为NO,Cu+被氧化为铜离子,离子方程式Cu++NO2-+2H+=Cu2++NO↑+H2O。
(3)将38.4 g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
① 设NO的物质的量是x mol、NO2的物质的量是y mol;根据元素守恒![]() ,根据电子守恒
,根据电子守恒![]() ,解得x=0.35、y=0.15,NO2的体积为3.36L。
,解得x=0.35、y=0.15,NO2的体积为3.36L。
②表现酸性的硝酸![]() mol,表现氧化性的硝酸
mol,表现氧化性的硝酸![]() mol,原硝酸溶液的浓度为
mol,原硝酸溶液的浓度为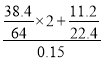 =11.3molL-1。
=11.3molL-1。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】下列对一些实验事实的解释正确的是
选项 | 实验事实 | 解释 |
A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子,且苯与水互不相溶 |
D | H2O的沸点高于H2S | H-O键的键长比H-S键的键长短 |
【题目】有机合成在制药工业上有着极其重要的地位。现用硝基苯制取苯胺,再用苯胺制得无 色晶体乙酰苯胺(具有退热镇痛作用的药物)。
①化学反应原理为:
![]()
②相关物质的物理常数
物质 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | ||||
苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |
③制备乙酰苯胺的装置及过程如下图所示:
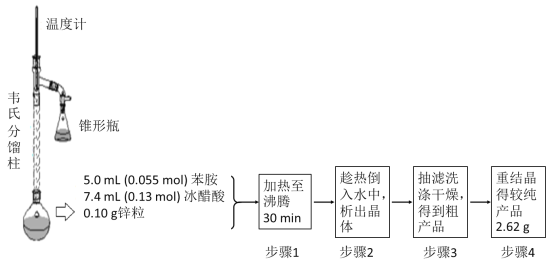
已知:Ⅰ苯胺易被氧化;Ⅱ韦氏分馏柱作用与原理类似于冷凝管
请回答以下问题:
(1)加入锌粒的目的是___________;韦氏分馏柱作用的是_________;
(2)步骤1中保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是_____________;
(3)步骤2中将反应液倒入水中的目的是___________;
(4)步骤3中洗涤剂最好选择______________;
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(5)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→________→__________→抽滤→洗涤→干燥;
(6)上述制备过程的产率是____________。(结果保留4位有效数字)。
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是: ,非金属性最强的是 (填具体元素符号,下同)。
(2)元素⑤的氢氧化物与盐酸反应的离子方程式_____ ____。
(3)用电子式表示元素④与⑦的化合物的形成过程: 。