题目内容
11.已知:4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石)△H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石)△H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l)△H=-8.4kJ/mol.
分析 写出目标反应的方程式,然后根据盖斯定律及已知热化学方程式计算出目标反应的反应热,再写出目标反应的热化学方程式.
解答 解:①4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石)△H=-1080.9kJ/mol,
②4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石)△H=-357.5kJ/mol,
根据盖斯定律,①-②×3可得:6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l)△H=-8.4kJ/mol,
故答案为:6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l)△H=-8.4kJ/mol.
点评 本题考查了用盖斯定律进行有关反应热的计算,题目难度中等,注意掌握盖斯定律的概念及含义,明确热化学方程式的书写原则,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
2.下列说法中正确的是( )
| A. | NO2、SO2、BF2、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有8个 | |
| D. | 单质的晶体中一定不存在的微粒是阴离子 |
19.下列物质中与钠、苛性钠、小苏打均能发生反应的是( )
| A. | 乙醇 | B. | 苯酚 | C. | 乙酸 | D. | 乙醛 |
6.分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )
①两溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
①两溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
| A. | ①② | B. | ② | C. | ②③ | D. | ④ |
16.在一定体积的密闭容器中通入amolNO和bmolO2,反应后容器内氮原子个数与氧原子个数之比为( )
| A. | $\frac{a}{b}$ | B. | $\frac{a}{a+b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{a}{2a+b}$ |
3.下列物质中,属于新型无机非金属材料的是( )
| A. | 有色玻璃 | B. | 碳化硅陶瓷 | C. | 石英玻璃 | D. | 钢化玻璃 |
20.下列离子方程式正确的是( )
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 氯化钠与浓硫酸混合加热:H2SO4+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+Cl2↑+H2O |
1.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | Cl-的结构示意图 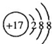 | D. | 质量数为37的氯原子${\;}_{17}^{37}Cl$ |