题目内容
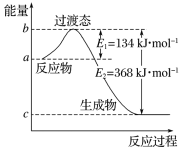
【题目】重铬酸钾别名为红矾钾,室温下为橙红色晶体,溶于水,不溶于乙醇。它被国际癌症研究机构划归为第一类致癌物质,而且是强氧化剂,在实验室和工业中都有很广泛的应用。实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。相关资料如下:
序号 | 资料 |
① | Cr2(SO4)3溶液呈绿色 |
② | 酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2 |
③ | CrO5可溶于水,易溶于乙醚得到蓝色溶液 |
④ | 乙醚是一种无色不溶于水,密度比水小的有机溶剂,化学性质稳定 |
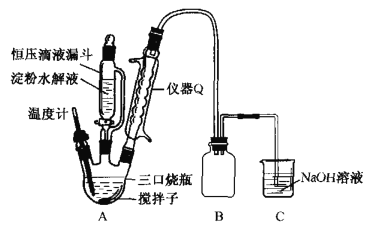
甲同学采用如图装置进行实验,探究了酸性条件下K2Cr2O7溶液和H2O2溶液的反应产物,实验步骤、操作等内容如下:
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装仪器 | —— |
Ⅱ | ? | —— |
Ⅲ | 向盛有H2O2溶液的仪器X中加入一定量的K2Cr2O7溶液和硫酸 | 溶液立即变为紫红色,此时pH=1,观察到溶液中持续产生气泡,最终溶液变为绿色 |

回答下列问题:
(1)用以上装置证明实验中产生的气体有氧气,装置的连接顺序是a→__→__→__→__。
(2)图中仪器X的名称是___。
(3)实验步骤Ⅱ是___。
(4)实验中紫红色溶液含有CrO5。
①验证紫红色溶液中含有CrO5的操作及现象是___。
②已知CrO5的结构式为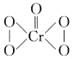 ,生成CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
,生成CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
(5)对上述实验中产生氧气、溶液变为绿色的原因,做出的假设①是CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。你还能做出的假设②是___。
(6)设计实验,选择合适的试剂,验证(5)中的假设①,你的设计是___。
【答案】e d b(c) c(b) 锥形瓶 检验装置的气密性 取少量紫红色溶液加入试管中,加入乙醚,振荡、静置,液体分为两层,上层呈蓝色 Cr2O72-+4H2O2+2H+=2CrO5+5H2O CrO5在酸性溶液中与H2O2反应生成Cr3+和O2 取一定体积的CrO5的乙醚溶液加入盛有一定体积的pH=1的硫酸中,观察现象,如果乙醚层由蓝色变为无色,水层变为绿色,则说明假设①成立
【解析】
(1)根据氧气和铜反应生成黑色的氧化铜进行检验氧气的产生;制取气体的装置必须先检查装置的气密性;
(2)①CrO5可溶于水,易溶于乙醚得到蓝色溶液,可以此检验;
②酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,且生成CrO5的反应不是氧化还原反应;
(3)①实验II步骤i中消耗的CrO5与生成的O2的物质的量之比为2:3,反应中Cr元素化合价由+6价降低为+3价,0元素化合价由-1价升高到0价,且生成过氧化氢;②O2来源于CrO5、H2O2中的-1价O且-1价O过量,当CrO5的量相同时,生成O2的体积相同;
(4)溶液中持续产生气泡,最终溶液变为绿色,生成的气体为氧气,且生成Cr3+。
(1)用以上装置证明实验中产生的气体有氧气,产生的气体干燥后通入铜粉,铜粉是否变色判定是否有氧气生成,故装置的连接顺序是![]() ,故答案为:e、d、
,故答案为:e、d、![]() 、
、![]() ;
;
(2)图中仪器X的名称是锥形瓶,故答案为:锥形瓶;
(3)在进行正式实验前首先要检验装置的气密性,故实验步骤Ⅱ是:检验装置的气密性,故答案为:检验装置的气密性;
(4)实验中紫红色溶液含有CrO5。![]() 验证紫红色溶液中含有CrO5的操作及现象是:取少量紫红色溶液加入试管中,加入乙醚,振荡、静置,液体分为两层,上层呈蓝色,故答案为:取少量紫红色溶液加入试管中,加入乙醚,振荡、静置,液体分为两层,上层呈蓝色;
验证紫红色溶液中含有CrO5的操作及现象是:取少量紫红色溶液加入试管中,加入乙醚,振荡、静置,液体分为两层,上层呈蓝色,故答案为:取少量紫红色溶液加入试管中,加入乙醚,振荡、静置,液体分为两层,上层呈蓝色;
生成CrO5的反应,不是氧化还原反应,则该反应的离子方程式为:Cr2O72-+4H2O2+2H+=2CrO5+5H2O,故答案为:Cr2O72-+4H2O2+2H+=2CrO5+5H2O;
(5)对上述实验中产生氧气、溶液变为绿色的原因,做出的假设①是CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2;还能做出的假设②是CrO5在酸性溶液中与H2O2反应生成Cr3+和O2,故答案为:CrO5在酸性溶液中与H2O2反应生成Cr3+和O2;
(6)设计实验,选择合适的试剂,验证(5)中的假设①,就是验证CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2,故可设计为:取一定体积的CrO5的乙醚溶液加入盛有一定体积的![]() 的硫酸中,观察现象,如果乙醚层由蓝色变为无色,水层变为绿色,则说明假设①成立,故答案为:取一定体积的CrO5的乙醚溶液加入盛有一定体积的
的硫酸中,观察现象,如果乙醚层由蓝色变为无色,水层变为绿色,则说明假设①成立,故答案为:取一定体积的CrO5的乙醚溶液加入盛有一定体积的![]() 的硫酸中,观察现象,如果乙醚层由蓝色变为无色,水层变为绿色,则说明假设①成立。
的硫酸中,观察现象,如果乙醚层由蓝色变为无色,水层变为绿色,则说明假设①成立。

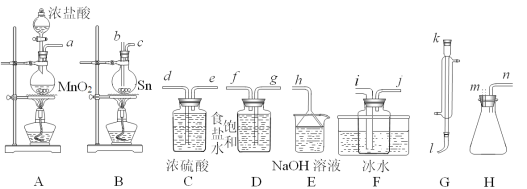
【题目】四氯化锡(SnCl4)常作有机合成的催化剂,在空气中极易水解生成SnO2·xH2O,实验室用熔融的锡(熔点为231.9℃)与氯气反应来制备(同时有SnCl2生成),该反应是放热反应。可选用的仪器及装置如图所示。
SnCl2、SnCl4有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
(1)已知SnCl2、SnCl4晶体类型相同,SnCl2熔沸点高于SnCl4的原因是:___。
(2)选择装置进行连接(填各接口的字母,装置可重复使用,空格可不填满)。___
a→__,__→__,__→__,__→__,__→__,__→__,__→__,__→__。
(3)反应开始时,应先点燃装置___(填“A”或“B”,下同)的酒精灯,待___时,再点然装置___的酒精灯,并在反应进行中仍持续加热,其目的是___。
(4)该方法制得的SnCl4中含有少量SnCl2,提纯SnCl4的实验名称是___。
(5)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液V mL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-,SnCl2的相对分子质量为:190)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量__(填“偏高”或“偏低”或“无影响”)。
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是___(填编号)。若测定结果偏高其原因可能是__(填字母)。
A.配制标准溶液的固体NaOH中混有Na2O杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是___。
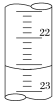
(3)如图是某次滴定时滴定管中的液面,其读数为___mL。
(4)根据下列数据,请计算待测盐酸的浓度:___molL-1。
滴定次数 | 待测体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |