题目内容
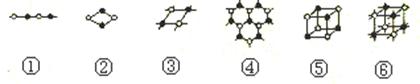
碳的两种同素异形体金刚石和石墨晶体结构如图(石墨晶体中是由一个个正六边形组成的片层结构,层与层之间靠微弱的范德华力结合)下列说法正确的是
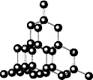
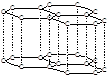
金刚石 石墨
C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ?mol-1
说明金刚石比石墨稳定,石墨转变为金刚石为放热反应

金刚石 石墨
| A.现代科技已经实现了石墨制取金刚石,该过程属于化学变化 |
| B.相同质量的金刚石与石墨晶体中,所含共价键数相同 |
| C.估计金刚石与石墨的熔沸点均较高,硬度均较大 |
| D.根据:C(金刚石,s)+O2(g)===CO2(g)ΔH=-395.41 kJ?mol-1 |
说明金刚石比石墨稳定,石墨转变为金刚石为放热反应
A
试题分析:同素异形体之间的转化是化学变化,A正确;相同质量的金刚石与石墨晶体中,所含共价键数前者多,B不正确;石墨的硬度较小,C不正确;根据盖斯定律可知,金刚石转化为石墨的反应是放热反应,所以金刚石的能量高于石墨的,石墨比金刚石稳定,D不正确,答案选A。
点评:体系能量越低,是越稳定的,据此可以判断物质的稳定性。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
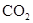 转化为具有类似
转化为具有类似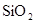 结构的原子晶体,下列关于
结构的原子晶体,下列关于