题目内容
2.下列离子方程式正确的是( )| A. | Fe(OH)2溶于稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O | |
| B. | H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑ | |
| C. | 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | 等体积等物质的量浓度的Ba(OH)2溶液与明矾溶液混合3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
分析 A.稀硝酸具有强氧化性,能够将亚铁离子氧化成铁离子;
B.氧气中的氧元素完全来自过氧化钠,氧气中不会含有18O,且过氧化钠不能拆开;
C.离子方程式两边负电荷不相等,不满足电荷守恒;
D.氢氧化钡与硫酸铝钾的物质的量相等,氢氧根离子、钡离子不足,反应生成硫酸钡和氢氧化铝沉淀.
解答 解:A.氢氧化亚铁和稀硝酸发生氧化还原反应生成铁离子、NO和水,正确的离子方程式为:3Fe(OH)2+NO3-+10H+=3Fe3++NO↑+8H2O,故A错误;
B.Na2O2既是氧化剂有时还原剂,水没有参与氧化还原反应,18O应该在氢氧化钠中,其过氧化钠不能拆开,正确的离子方程式为:2H218O+2Na2O2=218OH-+2OH-+4Na++O2↑,故B错误;
C.铝片跟氢氧化钠溶液反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故C错误;
D.等体积等物质的量浓度的Ba(OH)2溶液与明矾溶液混合,氢氧根离子、钡离子不足,反应生成硫酸钡和氢氧化铝沉淀,反应的离子方程式为:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确判断离子方程式正误常用方法,B为易错点,注意Na2O2既是氧化剂有时还原剂,水没有参与氧化还原反应,18O应该在氢氧化钠中.

练习册系列答案
相关题目
12.减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.
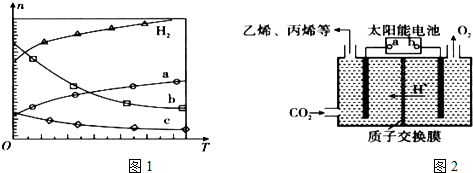
①该反应的△H<0(填“>”、“=”或“<”).
②曲线b表示的物质为H2O.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是加压(或不断分离出水).
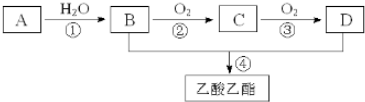
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
b为电源的正极,电解时,生成乙烯的电极反应式是2CO2+12e-+12H+=C2H4+4H2O.
Ⅱ.(3)用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①Tl℃时,该反应的平衡常数K=$\frac{9}{16}$.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2(答一种即可).
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.

①该反应的△H<0(填“>”、“=”或“<”).
②曲线b表示的物质为H2O.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是加压(或不断分离出水).
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
b为电源的正极,电解时,生成乙烯的电极反应式是2CO2+12e-+12H+=C2H4+4H2O.
Ⅱ.(3)用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2(答一种即可).
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
13.甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
①甲由水电离出来的H+的物质的量浓度是乙的$\frac{1}{10}$倍
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍.
①甲由水电离出来的H+的物质的量浓度是乙的$\frac{1}{10}$倍
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍.
| A. | ①②④正确 | B. | ①③正确 | C. | ②④正确 | D. | 只有①正确 |
10.下列关于化学反应及相关概念的叙述不正确的是( )
①通过化学变化可以实现16O 与18O 间的相互转化;
②凡是生成盐和水的反应都是中和反应;
③碱性氧化物一定是金属氧化物;
④只由一种元素组成的物质一定为纯净物;
⑤生成一种单质和一种化合物的反应一定是置换反应;
⑥两种碱之间一定不能发生反应.
①通过化学变化可以实现16O 与18O 间的相互转化;
②凡是生成盐和水的反应都是中和反应;
③碱性氧化物一定是金属氧化物;
④只由一种元素组成的物质一定为纯净物;
⑤生成一种单质和一种化合物的反应一定是置换反应;
⑥两种碱之间一定不能发生反应.
| A. | ①③④⑤⑥ | B. | ②④⑤ | C. | ①③⑥ | D. | ①②④⑤⑥ |
7.某条件下,一定物质的量的铁和铝分别与足量盐酸反应,若生成气体的体积相同,则铁和铝的用量关系正确的是( )
| A. | 质量比为1:1 | B. | 质量之比为28:9 | ||
| C. | 物质的量之比为2:3 | D. | 物质的量之比为1:1 |
14.摩尔质量最大的化合物是( )
| A. | NO2 | B. | NaOH | C. | Cl2 | D. | HCl |
12.在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度不可能的是( )
| A. | Z为0.3 mol•L-1 | |
| B. | X2为0.15 mol•L-1,Z为0.1 mol•L-1 | |
| C. | c(X2)+c(Y2)+c(Z)=0.6 mol•L-1 | |
| D. | c(X2)+c(Y2)+c(Z)=0.55 mol•L-1 |
 .
. ,取代反应.
,取代反应.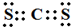 .
.