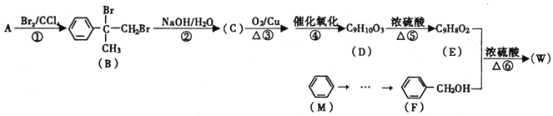
题目内容
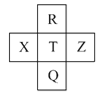
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
【答案】B
【解析】
R单质在暗处与H2剧烈化合并发生爆炸,则R为F元素,由元素在周期表中的位置可知,T为Cl元素,Q为Br元素,X为S元素,Z为Ar元素。
A.Z为Ar元素,最外层为稳定结构,金属性与非金属性在同周期中最弱,且同周期自左而右非金属性增强,非金属性Z<X<T,A项错误;
B.R为F元素,Q为Br元素,原子序数相差26,B项正确;
C.同主族自上而下,非金属性减弱,非金属性F>Cl>Br,非金属性越强,气态氢化物越稳定,稳定性HF>HCl>HBr,C项错误;
D.R为F,非金属性很强,没有最高价含氧酸,D项错误;
答案选B。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
【题目】下表是元素周期表的一部分,表中的字母分别代表一种化学元素。
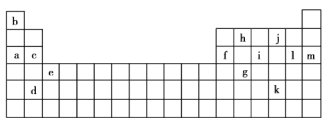
(1)a和c的I1大小关系是______大于______。(填字母)
(2)上述元素中,原子中未成对电子数最多的是______(填字母),写出该元素基态原子的核外电子排布式:______。
(3)根据下表所提供的电离能数据,回答下列问题。
锂 | X | Y | |
I1 | 520 | 496 | 580 |
I2 | 7296 | 4570 | 1820 |
I3 | 11799 | 6920 | 2750 |
I4 | 9550 | 11600 |
①表中X可能为以上13种元素中的______(填字母)元素。用元素符号表示![]() 和j形成的一种化合物的化学式:______。
和j形成的一种化合物的化学式:______。
②Y是周期表中第______族元素。
③以上13种元素中,______(填字母)元素原子失去核外第一个电子需要的能量最多。