题目内容
【题目】CO2和CH4在一定条件下合成乙酸:CO2+CH4![]() CH3COOH。完成下列填空:
CH3COOH。完成下列填空:
(1)①写出碳原子最外电子层的轨道表示式______
②钛(Ti)是22号元素,它是______(选填编号)
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(2)CS2分子的电子式为______;其熔沸点比CO2高,原因是______常温下,向1L pH=10的 NaOH溶液中持续通入CO2。通入CO2的体积(V)与溶液中水电离产生的OH﹣离子浓度(c)的关系如图所示
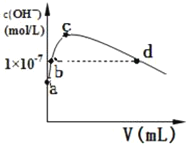
(3)c点溶液中离子浓度由大至小的关系是:______
(4)a点溶液中由水电离产生的c(H+)=______;b点溶液中c(H+)______1×10﹣7mol/L(填写“等于”、“大于”或“小于”)
(5)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是______(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
【答案】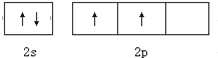 bd
bd ![]() 二者都为分子晶体,相对分子质量越大,分子间作用力越大 c(Na+)>c(CO32﹣)>c(HCO 3﹣) 1×10﹣10mol/L 小于 ad
二者都为分子晶体,相对分子质量越大,分子间作用力越大 c(Na+)>c(CO32﹣)>c(HCO 3﹣) 1×10﹣10mol/L 小于 ad
【解析】
(1)①C原子共2个电子层,最外层电子为2s、2p电子;
②钛(Ti)是22号元素,位于第四周期ⅣB族;
(2)CS2的电子式类似于CO2,二者都为分子晶体,相对分子质量越大,熔点越高;
(3)当水电离出的OH离子浓度最大时,说明此时的溶液是碳酸钠溶液,对水的电离起促进作用;
(4)水电离出的氢离子与氢氧根离子的浓度始终相等,a是没有通二氧化碳的情况,即pH=10的NaOH溶液,结合水的离子常数分析求解;b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×107mol/L;
(5)电离程度增大,电离平衡应正向移动,且pH增大,则酸性减弱,以此来解答。
(1)①C原子共2个电子层,最外层电子为2s、2p电子,最外电子层的轨道表示式为![]() ,故答案为:
,故答案为:![]() ;
;
②钛(Ti)是22号元素,位于第四周期ⅣB族,为长周期副族元素,故答案为:bd;
(2)CS2的电子式类似于CO2,电子式为![]() ,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高,故答案为:
,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高,故答案为:![]() ;二者都为分子晶体,相对分子质量越大,分子间作用力越大;
;二者都为分子晶体,相对分子质量越大,分子间作用力越大;
(3)当水电离出的OH离子浓度最大时,说明此时的溶液是碳酸钠溶液,对水的电离起促进作用,所以离子溶液浓度大小为c(Na+)>c(CO32﹣)>c(HCO3﹣),故答案为:c(Na+)>c(CO32﹣)>c(HCO3﹣);
(4)水电离出的氢离子与氢氧根离子的浓度始终相等,a是没有通二氧化碳的情况,即pH=10的NaOH溶液,则c(H+)=1×1010mol/L,而氢离子来源于水的电离,所以水电离出的c(H+)=1×1010mol/L,b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×107mol/L,故答案为:1×1010mol/L;小于;
(5)a.加水稀释,促进电离,且氢离子浓度减小,pH增大,故选;
b.加入少量乙酸钠固体,抑制电离,电离程度减小,故不选;
c.通氯化氢,酸性增强,pH减小,故不选;
d.加入少量苛性钠固体,促进电离,且氢离子浓度减小,pH增大,故选;
故答案为:ad。