题目内容
【题目】(1)配平该反应的化学方程式:___
① FeSO4+ KMnO4+ H2SO4= K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
②该反应中的氧化剂是___,氧化产物是____。
③若消耗3.16gKMnO4,则该反应转移的电子数目为____。
(2)已知反应:①Cl2+2KBr=2KCl+Br2,②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,③Br2+K2S=2KBr+S。
①下列说法正确的是__。
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为KMnO4>Cl2>Br2>S
C.反应②中还原剂与氧化剂的物质的量之比为8:1
D.反应③中1mol还原剂被氧化则转移电子的物质的量为2mol
②用单线桥法标出反应②中电子转移的方向和数目___。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
【答案】10FeSO4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O KMnO4 Fe2(SO4)3 0.1NA BD 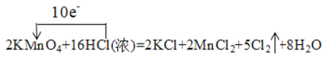
【解析】
(1)①该反应中Mn元素的化合价从+7价降低到+2价,Fe元素的化合价从+2价升高到+3价,根据得失电子守恒、元素守恒配平该方程式;
②根据化合价的变化判断;
③Mn元素的化合价从+7价降低到+2价,计算3.16g KMnO4的物质的量,从而计算高锰酸钾得电子数,转移电子数=氧化剂得电子数=还原剂失电子数,计算该反应转移的电子数目;
(2)①A.置换反应为一种单质和一种化合物反应生成另一种单质和另一种化合物;
B.根据氧化剂的氧化性大于氧化产物的氧化性判断;
C.根据化合价变化判断氧化剂、还原剂以及物质的量之比;
D.根据化合价变化判断还原剂以及转移电子物质的量;
②用单线桥法标出反应中电子转移的方向和数目时,电子从还原剂转移到氧化剂,根据化合价变化判断转移电子数目。
(1)①该反应中Mn元素的化合价从+7价降低到+2价,Fe元素的化合价从+2价升高到+3价,根据得失电子守恒、元素守恒配平该方程式为:10FeSO4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O;
故答案为:10FeSO4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O;
②该反应中Mn元素的化合价从+7价降低到+2价,得电子,被还原,KMnO4为氧化剂,Fe元素的化合价从+2价升高到+3价,失电子,被氧化,得到氧化产物,因此氧化产物为:Fe2(SO4)3;
古答案为:KMnO4;Fe2(SO4)3;
③3.16g KMnO4的物质的量为:![]() ,则其得电子数为:0.02mol×(7-2)=0.1mol,转移电子数=氧化剂得电子数=还原剂失电子数,则该反应转移的电子数目为0.1NA;
,则其得电子数为:0.02mol×(7-2)=0.1mol,转移电子数=氧化剂得电子数=还原剂失电子数,则该反应转移的电子数目为0.1NA;
故答案为:0.1NA;
(2)①A.置换反应为一种单质和一种化合物反应生成另一种单质和另一种化合物,则①③为置换反应,②不是置换反应,A项错误;
B.在反应①中,氯气是氧化剂,溴单质为氧化产物,反应②中高锰酸钾为氧化剂,氯气是氧化产物,反应③中溴单质为氧化剂,硫单质为氧化产物,根据氧化剂的氧化性大于氧化产物的氧化性可知,氧化性由强到弱顺序为KMnO4>Cl2>Br2>S,B项正确;
C.在反应②中②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,高锰酸钾为氧化剂,但只有部分盐酸为还原剂,当2mol高锰酸钾参加反应时,只有10mol盐酸被氧化,还原剂与氧化剂的物质的量之比为5:1,C项错误;
D.反应中③Br2+K2S=2KBr+S,还原剂为硫离子,1mol还原剂被氧化则转移电子的物质的量为2mol,D项正确;
故答案为:BD;
②用单线桥法标出反应②中电子转移的方向和数目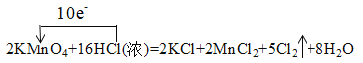 ;
;
故答案为: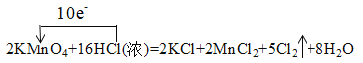 。
。

 小夫子全能检测系列答案
小夫子全能检测系列答案