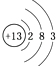��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���д���пհף�
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
��1������ЩԪ���У���ѧ��������õ��ǣ��������Ԫ�ط��ţ���ͬ����ԭ�ӽṹʾ��ͼΪ �� Ԫ�آ�����Ϊ�����ڱ��е�λ�� ��
��2��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ�� �� ������ǿ�Ļ�����ĵ���ʽ�ǣ� ��
��3���õ���ʽ��ʾԪ�آ���Ļ�������γɹ��̣� �� �û���������������ۡ������ӡ��������
��4����ʾ����ߵĻ�����ĵ���ʽ �� �û���������������ԡ������Ǽ��ԡ������γɵģ�
��5���ۡ��ޡ�������Ԫ���γɵ����ӣ����Ӱ뾶�ɴ�С��˳���� ��
��6��Ԫ�آ۵��⻯��ĽṹʽΪ�����⻯�ﳣ���º�Ԫ�آߵĵ��ʷ�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��Ar��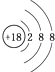 ���壻�������ڵڢ�A��
���壻�������ڵڢ�A��
��2��HClO4��![]()
��3��![]() ������
������
��4��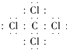 ������
������
��5��S2����Cl����O2��
��6��H��O��H��Cl2+H2O�THClO+HCl
���������⣺��Ԫ�������ڱ���λ�ã���֪��ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪS����ΪCl����ΪAr����ΪK����ΪBr����1��ϡ������Ar��ѧ�������ȶ���ԭ�Ӻ�����18�����ӣ���3�����Ӳ㣬���������Ϊ2��8��8��ԭ�ӽṹʾ��ͼΪ  ��Ԫ�آ�λ�ڵ������ڵڢ�A�壬Ϊ��Ԫ�أ� ���Դ��ǣ�Ar��
��Ԫ�آ�λ�ڵ������ڵڢ�A�壬Ϊ��Ԫ�أ� ���Դ��ǣ�Ar��  ���壻�������ڵڢ�A�壻��2�����������ˮ�����У�������ǿ�Ļ�������HClO4 �� ������ǿ�Ļ�������KOH���ɼ����������������ӹ��ɣ�����ʽΪ��
���壻�������ڵڢ�A�壻��2�����������ˮ�����У�������ǿ�Ļ�������HClO4 �� ������ǿ�Ļ�������KOH���ɼ����������������ӹ��ɣ�����ʽΪ�� ![]() �����Դ��ǣ�HClO4��
�����Դ��ǣ�HClO4�� ![]() ����3������Ļ�����ΪNa2S���õ���ʽ��ʾ�γɹ���Ϊ
����3������Ļ�����ΪNa2S���õ���ʽ��ʾ�γɹ���Ϊ ![]() ���������ӻ�������Դ��ǣ�
���������ӻ�������Դ��ǣ� ![]() �����ӣ���4������ߵĻ�����ΪCCl4 �� ������̼ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�����ʽΪ
�����ӣ���4������ߵĻ�����ΪCCl4 �� ������̼ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�����ʽΪ 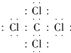 ��̼ԭ�ӡ���ԭ�ӶԹ��õ��Ӷ�������ͬ�����ڼ��Լ������Դ��ǣ�
��̼ԭ�ӡ���ԭ�ӶԹ��õ��Ӷ�������ͬ�����ڼ��Լ������Դ��ǣ� 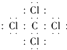 �����ԣ���5�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����ӵ��Ӳ�Խ�����Ӱ뾶Խ�����Ӱ뾶Ϊ��S2����Cl����O2�� �� ���Դ��ǣ�S2����Cl����O2������6��Ԫ�آ۵��⻯��ΪH2O����������ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ��ṹʽΪH��O��H����������Ӧ����HCl��HClO����Ӧ����ʽΪ��Cl2+H2O�THClO+HCl��
�����ԣ���5�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����ӵ��Ӳ�Խ�����Ӱ뾶Խ�����Ӱ뾶Ϊ��S2����Cl����O2�� �� ���Դ��ǣ�S2����Cl����O2������6��Ԫ�آ۵��⻯��ΪH2O����������ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ��ṹʽΪH��O��H����������Ӧ����HCl��HClO����Ӧ����ʽΪ��Cl2+H2O�THClO+HCl��
���Դ��ǣ�H��O��H��Cl2+H2O�THClO+HCl��

 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�����Ŀ���������ж�����Ԫ�����ʵ����ݣ����й��ڱ���11��Ԫ�ص�˵����ȷ���ǣ� ��
Ԫ�� | �� | �� | �� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶��10��10m�� | �� | 0.37 | 0.74 | 0.75 | 0.77 | 0.82 | 0.99 | 1.10 | 1.52 | 1.60 | 1.86 |
����� | 0 | +1 | +5 | +4 | +3 | +7 | +5 | +1 | +2 | +1 | |
��2 | ��3 | ��4 | ��1 | ��3 |
A.�ϱ���11��Ԫ�����γɵķǽ������ʶ��зǼ��Թ��ۼ�
B.�ڢᴦ��ͬһ���ڣ��ܢദ��ͬһ����
C.�ϱ���11��Ԫ��������������Ӧ��ˮ�����Тߺ�������ǿ
D.��ԭ�ӽṹʾ��ͼΪ