题目内容
【题目】现有下列短周期元素性质的数据:下列关于表中11种元素的说法正确的是( )
元素 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
原子半径(10﹣10m) | ﹣ | 0.37 | 0.74 | 0.75 | 0.77 | 0.82 | 0.99 | 1.10 | 1.52 | 1.60 | 1.86 |
最高或最 | 0 | +1 | +5 | +4 | +3 | +7 | +5 | +1 | +2 | +1 | |
﹣2 | ﹣3 | ﹣4 | ﹣1 | ﹣3 |
A.上表中11种元素中形成的非金属单质都有非极性共价键
B.②⑨处于同一周期,④⑧处于同一主族
C.上表中11种元素中最高价氧化物对应的水化物中⑦号酸性最强
D.⑥原子结构示意图为 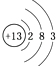
【答案】C
【解析】解:短周期元素,①表现0价,为零族元素;②⑨都有最高价+1,处于ⅠA族,原子半径②<⑨<,则②为H、⑨为Li、为Na;③只有最低价﹣2,则③为O;④⑧都有+5、﹣3价,处于ⅤA族,且原子半径④<⑧,则④为N、⑧为P;⑤有+4\﹣4价,处于ⅣA族,原子半径,小于P,故⑤为C;⑦有+7、﹣1价,则⑦为Cl;⑩有+2价,没有负价,处于ⅡA族,原子半径仅小于Na,则⑩为Mg;⑥+3价,没有负价,处于ⅢA族,原子半径小于Cl,则⑥为B, A.①表现0价,为零族元素,单质不存在共价键,故A错误;
B.④⑧都有+5、﹣3价,均处于ⅤA族,②为H、⑨为Li,二者处于同主族,故B错误;
C.最高价氧化物对应的水化物中酸性最强为高氯酸,⑦为Cl元素,其最高价氧化物对应的水化物中酸性最强,故C正确;
D.⑥为B,原子结构示意图为  ,故D错误,
,故D错误,
故选C.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同),原子结构示意图为 . 元素⑩名称为在周期表中的位置 .
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 , 碱性最强的化合物的电子式是: .
(3)用电子式表示元素④与⑥的化合物的形成过程: , 该化合物属于(填“共价”或“离子”)化合物.
(4)表示①与⑦的化合物的电子式 , 该化合物是由(填“极性”、“非极性”)键形成的.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是 .
(6)元素③的氢化物的结构式为;该氢化物常温下和元素⑦的单质反应的化学方程式为 .
