题目内容
(13分)近些年来,世界各地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫等是导致极端天气的重要因素,研究这些化合物的综合处理具有重要意义。
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)  ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s) 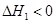
第2步:NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 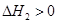
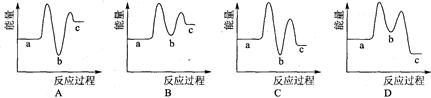
下列示意图中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号) 。
(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3
的转化率随时间的变化关系如图所示。
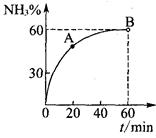
①A点的逆反应速率v逆(CO2) B点的逆反应速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②达到平衡时,CO2的转化率为 。
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入 0.100molNO 和2.030mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。计算K1= ,根据题给信息判断,T1和T2的关系是 。
A. T1>T2 B. T1<T2 C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响
。
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)  ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g)
 NH2COONH4(s)
NH2COONH4(s) 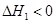
第2步:NH2COONH4(s)
 CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 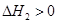
下列示意图中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号) 。

(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3
的转化率随时间的变化关系如图所示。

①A点的逆反应速率v逆(CO2) B点的逆反应速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②达到平衡时,CO2的转化率为 。
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入 0.100molNO 和2.030mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 物质 物质n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。计算K1= ,根据题给信息判断,T1和T2的关系是 。
A. T1>T2 B. T1<T2 C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响
。
(13分)(1)较低温度(1分)
(2)C(1分)
(3)① < (1分) ②15%(2分)
(4)① C+2NO N2+CO2(2分)
N2+CO2(2分)
②9/16(写成小数也得分0.5625)(2分) C (2分)
③该反应气体分子总数不变,在其他条件不变时,压强升高,平衡不会移动,NO的转化率不会改变,压强升高,使NO浓度增加,反应速率增大。(2分)
(2)C(1分)
(3)① < (1分) ②15%(2分)
(4)① C+2NO
 N2+CO2(2分)
N2+CO2(2分)②9/16(写成小数也得分0.5625)(2分) C (2分)
③该反应气体分子总数不变,在其他条件不变时,压强升高,平衡不会移动,NO的转化率不会改变,压强升高,使NO浓度增加,反应速率增大。(2分)
试题分析:(1)根据反应自发进行的判断依据,该反应是焓减熵减的反应,所以反应在低温时自发;
(2)2NH3(g)+CO2(g)
 NH2COONH4(s)
NH2COONH4(s) 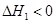 ,为放热反应,所以反应物总能量大于生成物总能量,则a在b的上方;NH2COONH4(s)
,为放热反应,所以反应物总能量大于生成物总能量,则a在b的上方;NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 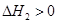 为吸热反应,则b在c的下方;2NH3(g)+CO2(g)
为吸热反应,则b在c的下方;2NH3(g)+CO2(g)  CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)  ,是放热反应,则a在c的上方,所以答案选选择C;
,是放热反应,则a在c的上方,所以答案选选择C;(3)①A点的氨气的转化率低于B点氨气的转化率,说明反应未达平衡,正向进行,所以正反应速率逐渐减小,逆反应速率逐渐增大,A点的逆反应速率<B点的逆反应速率;
②平衡时氨气的转化率为60%,设开始时氨气、二氧化碳的物质的量分别a、2a,则消耗氨气0.6a,消耗二氧化碳0.3a,所以二氧化碳的转化率为0.3a/2a×100%=15%;
(4)①T1℃时,消耗NO的物质的量是0.06mol,生成E、F的物质的量都是0.03mol,所以NO与E、F的化学计量数之比是2:1:1,则NO与活性炭反应的化学方程式C+2NO
 N2+CO2;
N2+CO2;②根据表中数据计算K1=c(CO2)c(N2)/c(NO)2=0.032/0.042=9/16;同理可计算K2=1/4,K1>K2,但是该反应的热效应未给出,所以T1和T2的大小无法判断,答案选C;
③根据压强对反应速率和平衡的影响,判断增加压强对该反应的影响是:该反应气体分子总数不变,在其他条件不变时,压强升高,平衡不会移动,NO的转化率不会改变,压强升高,使NO浓度增加,反应速率增大。

练习册系列答案
相关题目

 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )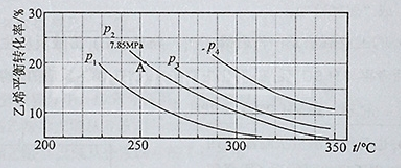
 CH3OH(g) △H<0,下列说法正确的是
CH3OH(g) △H<0,下列说法正确的是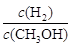 增大
增大 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。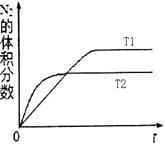
 zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是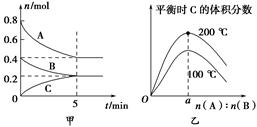
 Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H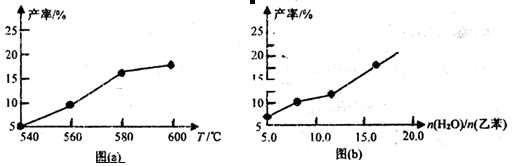

 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
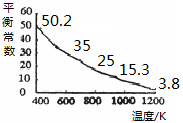
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( ) I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是