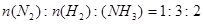题目内容
(15分)乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)? △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))? △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
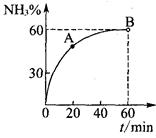
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
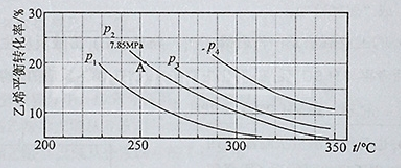
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)? △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))? △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)

①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
(1)C2H4+H2SO4= C2H5OSO3H; C2H5OSO3H+H2O=C2H5OH+ H2SO4;
(2) -45.5 污染小,腐蚀性小等;(3)①K=0.07(MPa)-1; ②P1< P2< P3< P4;反应分子数减少,相同温度下,压强升高,乙烯转化率提高; ③将产物乙醇液化转移去,增加n(H2O):n(C2H4)的比。
(2) -45.5 污染小,腐蚀性小等;(3)①K=0.07(MPa)-1; ②P1< P2< P3< P4;反应分子数减少,相同温度下,压强升高,乙烯转化率提高; ③将产物乙醇液化转移去,增加n(H2O):n(C2H4)的比。
试题分析:(1)根据题意可得乙烯与浓硫酸反应生成硫酸氢乙酯C2H5OSO3H的方程式:C2H4+H2SO4= C2H5OSO3H; C2H5OSO3H+H2O=C2H5OH+ H2SO4;(2)①-②-③,整理可得C2H4 (g)+H2O(g)=C2H5OH(g),△H=(-23.9+29.1-50.7)KJ/mol=-45.5 KJ/mol;与间接水合法相比,气相直接水合法的优点是污染小,腐蚀性小等;(3)①乙烯水合制乙醇反应在图中A点的平衡常数K
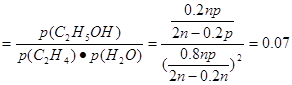 (MPa)-1; ②在相同的温度下由于乙烯是平衡转化率是P1< P2< P3< P4;由方程式C2H4 (g)+H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4; ③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变二者的物质的量的比等等。
(MPa)-1; ②在相同的温度下由于乙烯是平衡转化率是P1< P2< P3< P4;由方程式C2H4 (g)+H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4; ③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变二者的物质的量的比等等。
练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 CO(NH2)2(s)+H2O(g); △H<0
CO(NH2)2(s)+H2O(g); △H<0
 CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
 B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
 2C(g)的△H<0
2C(g)的△H<0
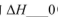 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
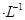 盐酸与0.2 mol
盐酸与0.2 mol (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数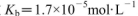 )
)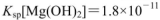 ,
,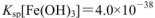 )
) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)  ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。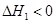
 物质
物质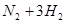

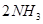 达到平衡的标志是( )。
达到平衡的标志是( )。

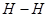 键断裂,同时6mol
键断裂,同时6mol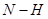 键断裂
键断裂