题目内容
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的
| A.A曲线代表25℃时水的电离平衡曲线 |
| B.当95℃时,pH=6的溶液呈中性 |
| C.25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4 溶液混合,所得溶液的pH=7 |
| D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸 |
D
解析试题分析:A、A曲线上离子积Kw为10-14(mol?L?1)2,所以A曲线代表25℃时水的电离平衡曲线,正确;B、当95℃时,pH=6时,c(H+)=c(OH?)= 10-6mol?L?1,溶液呈中性,正确;C、10mLpH=12的NaOH溶液中OH-的物质的量为0.0001mol,1mLpH=1的H2SO4 溶液中H+的物质的量为0.0001mol,恰好完全反应,所得溶液的pH=7,正确;D、95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,反应后的溶液呈中性,说明HA为强酸,错误。
考点:本题考查水的电离平衡、酸碱中和反应、酸碱性的判断。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目
常温时,下列叙述正确的是
| A.pH=9的NH4Cl与NH3·H2O混合溶液中c(Cl-)>c(NH4+) |
| B.pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的1 0倍 |
| C.AgCl在0.1 mol/L CaCl2溶液和0.l mol/L NaCl溶液中的溶解度相同 |
| D.1 mL l mol l L Na2CO3溶液加水稀释至100 mL,pH和Kw均减小 |
下列物质中,属于弱电解质的是( )
| A.氨水 | B.冰醋酸 | C.酒精 | D.硫酸钡 |
H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
| A.滴加新制氯水,溶液pH减小 | B.通入过量SO2气体,溶液pH增大 |
| C.加水,溶液中氢离子浓度增大 | D.加入少量硫酸铜固体,所有离子浓度都减小 |
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是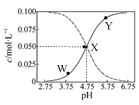
| A.Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B.W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol·L-1 |
| C.该温度下醋酸的电离平衡常数为10—4.75 mol·L-1 |
| D.向X点所表示的溶液中加入等体积的0.05 mol·L-1 NaOH溶液 :c(H+)=c(CH3COOH)+c(OH-) |
0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(HF)>c(OH-) | D.c(HF)>c(F-) |
常温下,pH=11的氨水溶液和pH=1的盐酸溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是( )
| A.弱碱的浓度大于强酸的浓度 |
| B.反应完全后的溶液呈碱性 |
| C.原氨水中有1%的含氮微粒为NH4+ |
| D.反应后的溶液中NH4+、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1 |
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是
A.W点所示的溶液中:c(Na+)+c(H+)=2c( )+c(OH-)+c(Cl-) )+c(OH-)+c(Cl-) |
B.pH=4的溶液中:c(H2CO3)+c(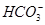 )+c( )+c( )<0.1 mol·L-1 )<0.1 mol·L-1 |
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(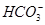 )=c(OH-)+c(Cl-) )=c(OH-)+c(Cl-) |
D.pH=11的溶液中:c(Na+)>c(Cl-)>c( )>c( )>c(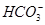 )>c(H2CO3) )>c(H2CO3) |