题目内容
【题目】下列变化过程属于还原反应的是( )
A.HCl→MgCl2B.Na→Na+C.CO→CO2D.Fe3+→Fe
【答案】D
【解析】
还原反应,是化合价降低的反应。
A、HCl→MgCl2,Cl的化合价没有变化,不是还原反应,A不符合题意;
B、Na→Na+,钠的化合价升高,是氧化反应,B不符合题意;
C、CO→CO2,C的化合价从+2升高到+4,是氧化反应,C不符合题意;
D、Fe3+→Fe,Fe的化合价从+3降低到0,是还原反应,D符合题意;
答案选D。

【题目】纳米氧化钴在半导体和微电子行业应用广泛,某些金属废料中含有Co元素,从废料(含Co3O4、Al2O3、Li2O、Fe2O3等物质) 中制备高纯度的纳米级钴的氧化物,流程如下
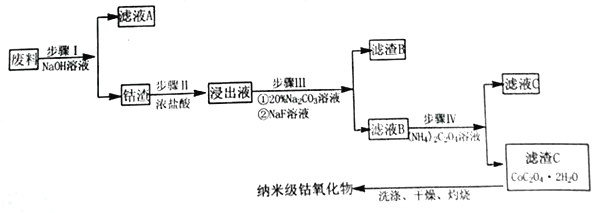
已知:
①LiF 难溶于水,Li2CO3微溶于水;
②钴元素常见的化合价为+2 和+3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中发生的离子反应方程式_______________;
(2)步骤II加浓盐酸的作用是_______________;
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为_______________; 滤渣 B 的主要成分为_________________;
(4)简述如何检验滤液B中是否还有残留的Fe3+:_______________;
(5) 经过反复洗涤、干燥后称重,将质量为3.66gCoC2O4·2H2O进行灼烧,残留固体质量如图所示。
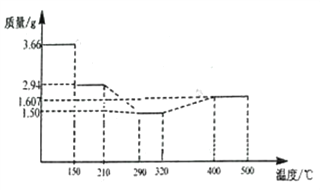
210℃~290℃时若生成两种气体,则发生反应的化学方程式为_______________,400℃~500℃所得固体的化学式为_______________;